Гомогенной системой называется такая система, внутри которой нет поверхностей раздела отделяющих друг от друга части системы, различающиеся по свойствам (свойства одинаковые или изменяются плавно от точки к точке).
Гетерогенная системасостоит из нескольких макроскопических частей, каждая из которых состоит из большого числа молекул, отделенных одна от другой видимыми поверхностями раздела, на этих поверхностях некоторые параметры могут изменяться скачком.
От этих понятий следует отличать понятия однородной и неоднородной систем.
Однородной называется система, в которой все участки объема обладают одинаковым составом (химически однородная система) и свойствами (физически однородная система).
В противоположном случае система называется неоднородной.
Неоднородная система, может быть и гомогенной, если ее состав и свойства изменяются постепенно от одного участка объема к следующим без образования поверхности раздела между ними.
Фаза-это термин, которым обозначается совокупность всех гомогенных частей системы, одинаковых по составу и по физическим и химическим свойствам (не зависящим от количества вещества) и ограниченных от других частей системы некоторой поверхностью (поверхностью раздела).
Фазы, состоящие из одного какого-нибудь химически индивидуального вещества, называют простыми (а также чистыми); а фазы, содержащие два индивидуальных вещества или больше - смешанными фазами.
Любая гомогенная система представляет собой одну фазу, гетерогенные системы содержат не менее двух фаз.
Каждая фаза характеризуется собственным уравнением состояния. В общем виде уравнение состояния термодинамической системы имеет вид:
¦(P,V,T,C,Ce,U,Sn…)=0, где
Р – давление;
V – объем;
Т – температура;
С – концентрация компонентов;
Се – концентрация заряда;
U – внутренняя энергия системы;
Sn – площадь поверхности системы.
Совокупность всех физических и химических свойств системы характеризует её состояние. Изменение каких-нибудь из этих свойств означает изменение состояния системы. Принято называть общим термином термодинамический параметр состояния (параметр состояния) любую из величин, служащих для характеристики состояния термодинамической системы- P,V,T,C…
Термодинамическая система называется изолированной, если она не может обмениваться веществом и энергией (в форме теплоты и работы) с окружающей средой и имеет постоянный объем.
Термодинамическая система может быть:
Равновесной – это такое состояние системы, при котором ряд свойств системы P,V,T,C и.т.д. не изменяется самопроизвольно во времени, и имеют одинаковые значения во всех точках объема отдельных фаз.
Неравновесное состояние характеризуется неравномерным и изменяющимся во времени распределением термодинамических параметров внутри фаз.
Первый закон термодинамики является постулатом; он не может быть по существу доказан логическим путем, а вытекает из суммы человеческого опыта. Справедливость этого закона доказывается тем, что ни одно из следствий, к которым он приводит, не находится в противоречии с опытом.
Можно дать несколько формулировок первого закона, которые по существу равноценны.
U-внутренняя энергия системы - это функция состояния системы, являющаяся суммарной мерой всех энергий системы.
Закон сохранения энергии в применении его к термодинамическим процессам является одним из выражений первого закона термодинамики.
Если в каком-нибудь процессе энергия одного вида исчезает, то взамен ее появляется энергия в другой форме в количестве, строго эквивалентном первому.
Другими словами: Внутренняя энергия системы находящейся в данном состоянии имеет одно значение и не зависит от того, каким изменениям подвергалась система при переходе к данному состоянию.
U-однозначная, непрерывная и конечная функция.
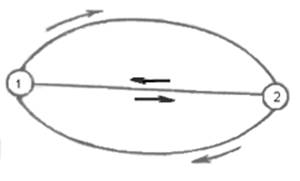
![]()
Разобьем интеграл по замкнутому контуру на 2 простых интеграла:
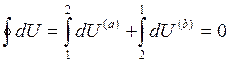
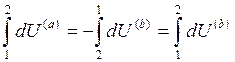
Приращение внутренней энергии системы при переходе её из одного состояния в другое, не зависит от пути процесса, а зависит только от начального и конечного состояния системы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.