Все эти силы – это силы притяжения. При сближении молекул адсорбата с молекулами адсорбента эти силы притяжения уравновешиваются силами отталкивания.
Хемиосорбция – между поверхностью адсорбента и молекулой адсорбата возникает прочная химическая связь с образованием нового химического поверхностного соединения.
Физическая адсорбция идет быстро, с повышением температуры поверхности скорость уменьшается, с понижением – повышается.
Хемиосорбция при низких температурах идёт медленно, с повышением температуры скорость хемиосорбции повышается, подобно скорости химической реакции.
Физическая адсорбция – низкоэнергетическая, ее энергия сравнима с теплотой конденсации (испарения), для органических растворов энергия адсорбции 8-15 кДж/моль. Для металлов от 10 до 40 кДж/моль.
Энергия хемиосорбции сравнима с теплотой химической реакции от 50 до 400 кДж/моль.
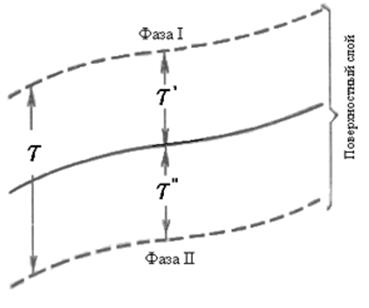
Рассмотрим равновесие поверхностного слоя с двумя соседними объемными фазами. В этом создаются некоторые избытки концентрации компонентов вследствие изменения концентрации компонентов в поверхностном слое по сравнению с однородными соседними фазами.
 Условием равновесия
адсорбирующего слоя соприкасающегося с объемными фазами является обобщение
условий гетерогенного равновесия системы, состоящей из однородных объемных фаз.
При этом обобщении учитывается наличие промежуточного слоя между однородными
фазами.
Условием равновесия
адсорбирующего слоя соприкасающегося с объемными фазами является обобщение
условий гетерогенного равновесия системы, состоящей из однородных объемных фаз.
При этом обобщении учитывается наличие промежуточного слоя между однородными
фазами.
Общее условие равновесия любой замкнутой системы при постоянных значениях энтропии S, общего объема V и общего количества каждого из компонентов является минимум её внутренней энергии.
Для равновесия замкнутой системы состоящей из двух объемных фаз I и II поверхностного слоя между ними, должно соблюдатся следующее условие:
![]() (1)
(1)
где ![]() и
и ![]() -
изменение внутренней энергии объемных фаз I и II,
-
изменение внутренней энергии объемных фаз I и II, ![]() -
изменение внутренней энергии поверхностного слоя.
-
изменение внутренней энергии поверхностного слоя.
Имеем неоднородный в направлении к нормали поверхности раздела слой с поверхностью Sn между объемными фазами. Толщина этого слоя невелика, так как разность молекулярных сил у поверхности раздела вызванная неоднородностью поверхностного слоя быстро падает с расстоянием от поверхности раздела.
Считаем, что толщины
приграничных слоев ![]() и
и ![]() по обе
стороны
по обе
стороны ![]() таковы, что за
их пределами фазы I и II
однородны.
таковы, что за
их пределами фазы I и II
однородны.
Изменение внутренней энергии соприкасающихся с поверхностным слоем фаз I и II можно записать:
![]() (2)
(2)
![]() (3)
(3)
где ![]() и
и ![]() -
энтропия;
-
энтропия;
![]() и
и
![]() - объемы;
- объемы;
![]() и
и
![]() - число молей компонентов образующих фазы I и II;
- число молей компонентов образующих фазы I и II;
![]() и
и ![]() - температуры;
- температуры;
![]() и
и ![]() - давление;
- давление;
![]() и
и ![]() химические потенциалы компонентов i образующих фазы.
химические потенциалы компонентов i образующих фазы.
Изменение избытка внутренней энергии слоя Sn, рассчитывается как:
![]() (4)
(4)
Термодинамические параметры поверхности определяются
физической природой материала и его физическим состоянием, которое
характеризуется полной поверхностной энергией. Часть этой энергии, равная
максимальной полезной работе затрачиваемой на создание поверхности является
удельной поверхностной энергией Гиббса и называется поверхностным натяжением ![]() . Для жидких материалов
. Для жидких материалов ![]() определяется экспериментально и приводится
в справочниках. Для твердых материалов экспериментальное определение
затруднено, поэтому в расчетах можно принимать
определяется экспериментально и приводится
в справочниках. Для твердых материалов экспериментальное определение
затруднено, поэтому в расчетах можно принимать ![]() для
твердых материалов на 5-8% больше
для
твердых материалов на 5-8% больше ![]() для этих же материалов,
но жидких.
для этих же материалов,
но жидких.
Реальная поверхность практически всегда покрыта пленкой от 100 до 1000 нм, состоящей из оксидов, гидратов, жиров и т.д. и не является атомогладкой (для атомогладкой поверхности шероховатость не превышает размеры одного атома 50 нм).
В микроэлектронных изделиях большинство эксплуатационных свойств реализуется в приповерхностных слоях. Состояние поверхности влияет на электрофизические параметры приповерхностных слоев, вызывая адсорбцию заряженных частиц, появляются рекомбинационные центры и другие дефекты. Надежная работа ЭВС зависит от того, насколько хорошо подготовлена и защищена его поверхность от вредных внешних воздействий.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.