Энтропия твердого тела определяется по выражению (1).
При плавлении и переходе в жидкую фазу энтропия возрастает на величину приведенной теплоты плавления:
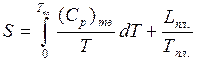 (2)
(2)
где ![]() - теплота плавления;
- теплота плавления;
![]() -
температура плавления.
-
температура плавления.
Если нагреть жидкость от ![]() до температуры
до температуры![]() , то
получим:
, то
получим:
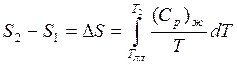 (3)
(3)
Энтропия пара может быть рассчитана:
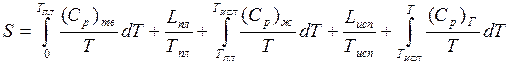 (4)
(4)
 Для практических расчетов необходимо знать значение
теплоемкости при постоянном давлении при температуре Т=10-80К, затем используют
уравнение Дебая или Тарасова экстраполируют значение
Для практических расчетов необходимо знать значение
теплоемкости при постоянном давлении при температуре Т=10-80К, затем используют
уравнение Дебая или Тарасова экстраполируют значение ![]() к
абсолютному нулю. По выражению (4) рассчитывается энтропия реального газа.
к
абсолютному нулю. По выражению (4) рассчитывается энтропия реального газа.
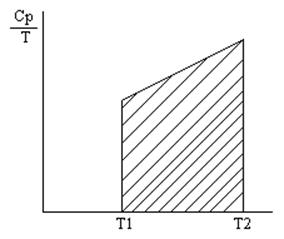
На практике интегральные выражения рассчитываются
графически (см рис.) - численное значение интеграла определяют по площади
заключенной между ![]() и
и ![]() .
.
Энтропия зависит от молекулярного веса, агрегатного состояния (твердое®жидкое®газообразное энтропия возрастает), кристаллического строения (углерод, алмаз), от структуры молекул.
Фазовые равновесия – это равновесия в системах, в которых не происходит химического взаимодействия между компонентами, а имеют место лишь фазовые переходы компонентов из одной фазы в другую.
Условие равновесия гетерогенной системы: во всех фазах гетерогенной термодинамической системы, Т и Р одинаковы и химические потенциалы m каждого из компонентов равны.
Химический потенциал – это величина, характеризующая способность компонента выделятся из данной фазы в рассматриваемых условиях.
Химический потенциал – это частная производная от энергии Ферми по концентрации данного компонента:
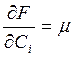
Одним из самых общих законов физической химии является закон равновесия фаз, называемый правилом фаз. Правило фаз основывается на втором законе термодинамики и относится к системам, находящимся в равновесии.
Возьмем систему, содержащую n – независимых компонентов и состоящую из k – фаз, находящихся в устойчивом равновесии между собой.
Составим уравнения выражающие условия равновесия для наиболее общего случая, когда все компоненты входят во все фазы, из которых состоит гетерогенная система:
n – число компонентов (1…n),
к – число фаз (1…к)
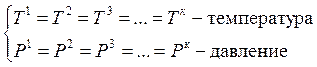 (1)
(1)
Выражение (1) ряды тождеств, т.к. Т и Р независимые переменные.
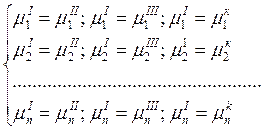 (2)
(2)
Выражение (2) это не ряды тождеств, т.к. химический потенциал одного компонента в различных фазах описывается различными функциями от Р, С, Т.
На основании (2) можно составить систему независимых уравнений.
Вид функции![]() меняется
от одной фазы к другой и в общем случае неизвестен, каждое из равенств
меняется
от одной фазы к другой и в общем случае неизвестен, каждое из равенств ![]() является независимым уравнением.
является независимым уравнением.
Общее количество уравнений составляющих систему будет равно:
![]()
Т, Р, С – независимые переменные входящие в систему независимых уравнений.
Для выражения состава любой фазы, содержащей n – компонентов, достаточно указать процентное содержание (n-1) компонентов. Следовательно для описания состава всех к – фаз нам может потребоваться к*(n-1) данных и для полного описания еще Т и Р т.е. всего к*(n-1)+2 данных.
Если число независимых переменных равно числу уравнений их связывающих, то каждая переменная принимает некоторое, строго определенное значение и вся система может существовать при этом единственно возможном сочетании Т, Р и С во всех фазах, если же число уравнений меньше числа независимых переменных то разность (f) – это число переменных которым можно придавать произвольные значения при имеющихся уравнениях, а следовательно при данном числе фаз:
![]() (3)
(3)
f – число термодинамических степеней свободы системы, или вариантность системы определяется как число условий ( температура, давление, концентрации), которые можно произвольно менять ( в известных пределах ), не изменяя этим числа или вида фаз системы.
Если f=1, то система моновариантная.
Если f=2, то система бивариантная.
Если f=0, то система нонвариантна.
Преобразуя (3) можно получить:
![]() (4)
(4)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.