











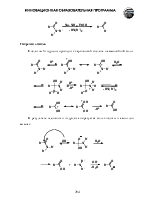









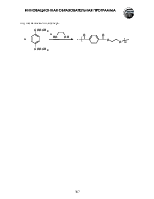








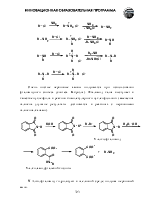





· Классификация, изомерия, номенклатура. Строение карбоксильной группы и карбоксилат-аниона. Эффект сопряжения, физические свойства карбоновых кислот, водородные связи и их влияние на физические свойства. Спектральные свойства карбоновых кислот.
· Методы получения: окисление углеводородов, спиртов, альдегидов, синтезы с использованием малонового и ацетоуксусного эфиров, диоксида углерода и металлоорганических соединений, гидролизом нитрилов, амидов, сложных эфиров и геминальных тригалогенопроизводных. Природные источники карбоновых кислот.
· Химические свойства. Кислотность, ее связь со строением углеродного радикала и стабильностью аниона в алифатическом и ароматическом рядах.
Карбоновыми кислотам называют вещества, в молекуле которых есть карбоксильная группа (карбокси-группа).
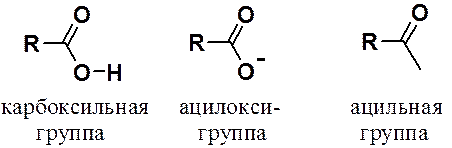
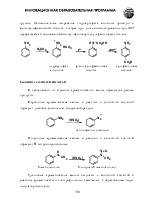
Карбоновые кислоты классифицируют по строению органического радикала, а также количеству и расположению карбоксильных групп. Соответственно карбоновые кислоты могут быть: алифатическими (насыщенными и ненасыщенными), алициклицескими, ароматическими, гетероциклическими, а также: монокарбоновыми, дикарбоновыми и т.д. – поликарбоновыми.
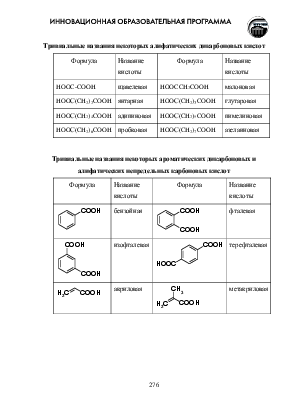
В названиях карбоновых кислот, наряду с номенклатурой UPAC (-овая кислота, -карбоновая кислота), используют тривиальные названия. Кислоты известны человечеству с древнейших времен, поэтому тривиальные названия глубоко укоренились и используются чаще систематических. Надо знать наизусть названия, по крайней мере: первых 10 монокарбоновых кислот и первых 6 дикарбоновых алканового ряда, простейших непредельных и ароматических, а также наиболее важных высших жирных кислот.
Кроме того, необходимо знать также названия радикалов, образующихся при мысленном удалении из карбокси-группы атома водорода (ацилокси-группа) и гидроксила (ацильная группа).
Тривиальные названия некоторых карбоновых кислот алканового ряда
и их радикалов
|
Формула
|
Название кислоты |
Название ацильной группы
|
Название ацилокси-группы
|
|
HCOOH |
муравьная |
формил |
формиат |
|
СH3COOH |
уксусная |
ацетил |
ацетат |
|
СH3CH2COOH |
пропионовая |
пропионил |
пропионат |
|
СH3(CH2)2COOH |
масляная |
бутирил |
бутират |
|
СH3(CH2)3COOH |
валериановая |
валерил |
валериат |
|
СH3(CH2)4COOH |
капроновая |
капронил |
капронат |
|
СH3(CH2)5COOH |
энантовая |
энантил |
энантиат |
|
СH3(CH2)6COOH |
каприловая |
каприлил |
каприлат |
|
СH3(CH2)7COOH |
каприновая |
капринил |
капринат |
Тривиальные названия некоторых алифатических дикарбоновых кислот
|
Формула |
Название кислоты |
Формула |
Название кислоты |
|
HOOC-COOH |
щавелевая |
HOOCCH2COOH |
малоновая |
|
HOOС(CH2)2COOH |
янтарная |
HOOС(CH2)3COOH |
глутаровая |
|
HOOС(CH2)4COOH |
адипиновая |
HOOС(CH2)5COOH |
пимелиновая |
|
HOOС(CH2)6COOH |
пробковая |
HOOС(CH2)7COOH |
азелаиновая |
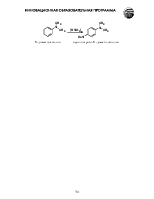
Тривиальные названия некоторых ароматических дикарбоновых и алифатических непредельных карбоновых кислот
|
Формула |
Название кислоты |
Формула |
Название кислоты |
|
|
бензойная |
|
фталевая |
|
|
изофталевая |
|
терефталевая |
|
|
акриловая |
|
метакриловая |
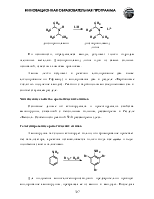
Получение карбоновых кислот:
· окислительным расщеплением двойной связи см. раздел «Алкены»;
· окислением первичных спиртов см. раздел «Спирты»;
· окислением альдегидов и галоформной реакцией см. раздел «Карбонильные соединения»;
· окислением гомологов бензола см. раздел «Бензол»;
· реакцией Кольбе-Шмитта см. раздел «Фенолы»;
Синтезы с использованием малонового и ацетоуксусного эфиров, гидролизом амидов и сложных эфиров будут рассмотрены следующих лекциях.
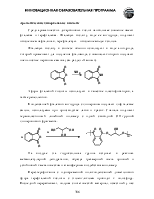
Общие методы синтеза:
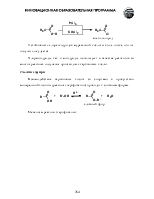
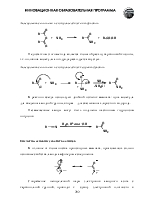
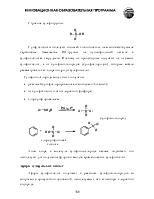
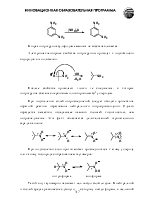
реакция реактивов Гриньяра с углекислым газом
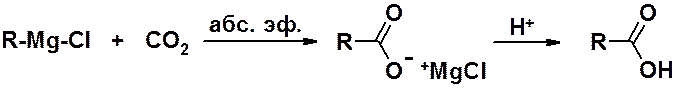
гидролиз геминальных григалогенопроизводных
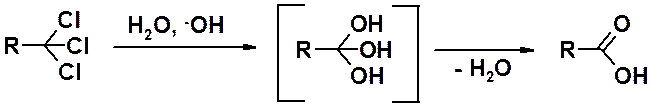
гидролиз нитрилов
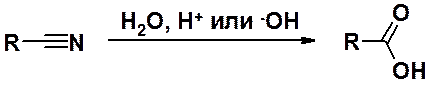
Высшие жирные кислоты, как правило, получают из растительного или животного сырья.
Низшие члены гомологического ряда, как обычно, в промышленности получают специфическими методами.
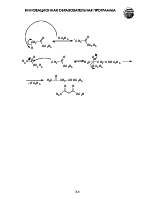
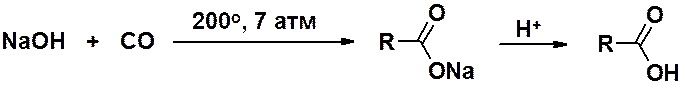
Муравьиную кислоту в больших количествах получают реакцией оксида углерода (II) с гидроксидом натрия при повышенных температуре и давлении.
Уксусную кислоту получают: окислением ацетальдегида, окислением этилена на палладиевом катализаторе и каталитическим окислительным расщеплением бутана кислородом воздуха.
Для получения низших карбоновых кислот может быть использовано присоединение угарного газа и воды к алкенам и алкинам с терминальной кратной связью в присутствии катализатора при высоких температуре и давлении.
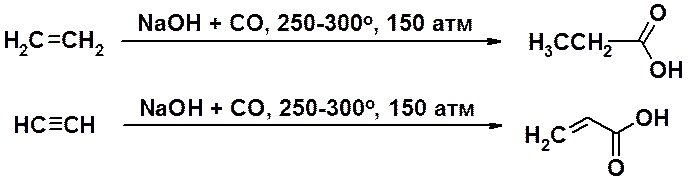
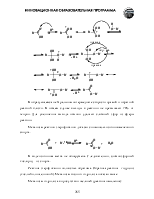
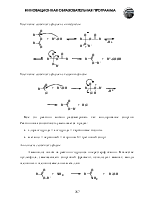
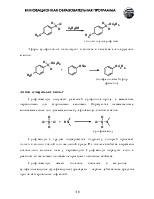
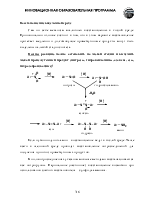
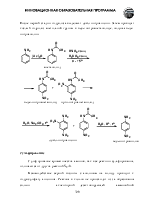
Хотя карбоксильная группа состоит из уже известных гидроксильной (спирты) и карбонильной (альдегиды и кетоны) групп, она не является их простой суммой.
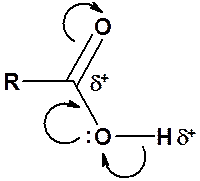
В результате акцепторных свойств атома кислорода, а также сопряжения пары электронов кислорода ОН-группы с p-электронами С-О двойной связи, атомы водорода и углерода карбонильной группы сильно позитивированы. Отсюда, возможно отщепление протона и взаимодействи атома углерода с нуклеофилами.
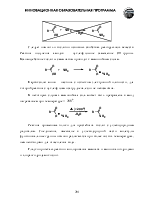
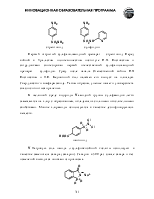
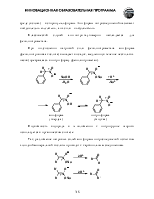
Карбоновые кислоты значительно легче отдают протон, чем спирты. Высокая кислотность объясняется большим недостатком (в сравнении со спиртами) электронной плотности на атоме водорода карбоксильной группы и высокой стабильностью, образующегося карбоксилат-аниона, который не может быть правильно изображен одной структурной формулой из-за сопряжения.
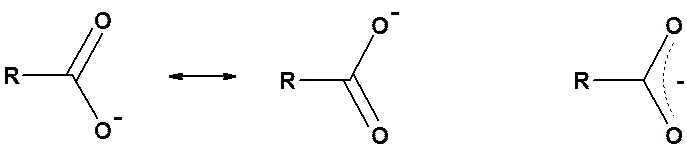
Рентгеноструктурный анализ солей карбоновых кислот однозначно показывает, что расстояния между углеродом и обоими атомами кислорода одинаковы. Из этого факта следует вывод: в карбоксилат-анионе нет ни С=О, ни С-О связей. Четыре электрона делокализованы с участием трех атомов.
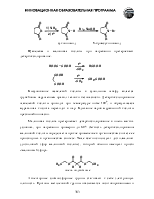
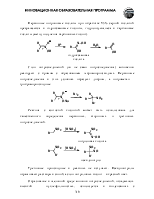
Строение углеводородного радикала способно сильно влиять на кислотность. Донорные заместители понижают кислотность, акцепторные – увеличивают.
Так, pKa муравьиной кислоты – 3,9, а уксусной – 4,8. Размер и строение алкильной группы слабо влияют на кислотность, которая у первых кислот (С2-С10) насыщенного ряда близка к показателю уксусной.
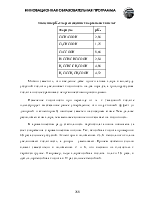
Влияние акцепторных заместителей можно проследить, анализируя зависимость pKa кислот от числа и положения атомов хлора в молекуле.
Значения pKa хлорзамещенных карбоновых кислот
|
Формула |
pKa |
|
ClCH2COOH |
2,86 |
|
Cl2CHCOOH |
1,25 |
|
Cl3CCOOH |
0,66 |
|
H3CCH2CHClCOOH |
2,84 |
|
H3CCHClCH2COOH |
4,06 |
|
H2ClCCH2CH2COOH |
4,52 |
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.