Каждая стадия проводится в избытке аммиака или соответствующего амина. Можно последовательно получить все производные.
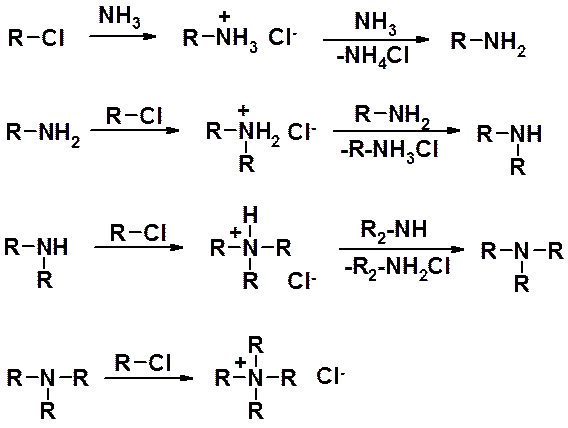
Очень чистые первичные амины получаются при использовании фталимидного синтеза (синтеза Габриэля). Фталимид калия выступает в качестве нуклеофила в реакции бимолекулярного нуклеофильного замещения галогена (лучшие результаты достигаются в реакциях с первичными галогеноалканами).
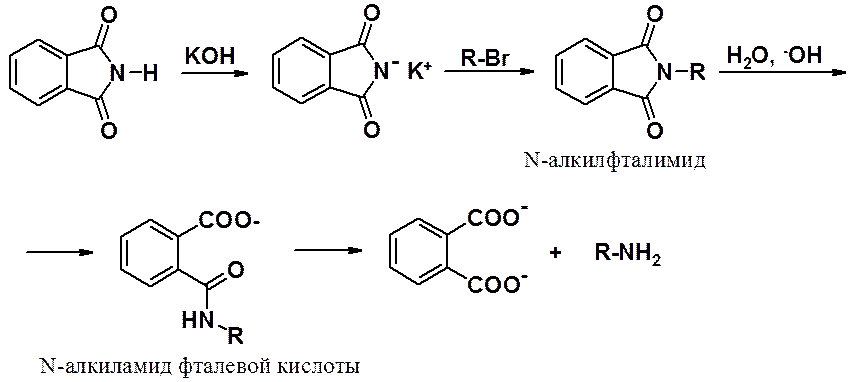
N-Алкилфталимид гидролизуют в щелочной среде, получая первичный амин.
Свойства аминов определяются строением соединения, производными которого они являются – аммиака.
Амины, как и аммиак, имеют свободную электронную пару, которую могут предоставлять для акцептирования протона, проявляя кислые свойства, или для взаимодействия с электрофилами, проявляя нуклеофильные свойства.
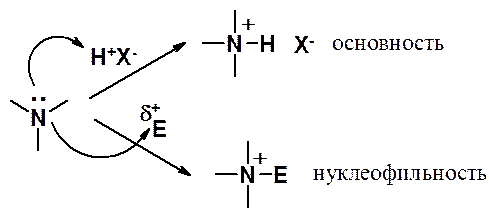
В обоих случая первоначально образуются аммонийные производные, стабильность которых зависит от условий реакции. Так, соли минеральных кислот и аминов устойчивы и при комнатной температуре могут храниться десятилетиями.
В аммонийных производных электронная пара азота использована для образования ковалентной связи. Поэтому они не могут проявлять ни основных, ни нуклеофильных свойств. Протонные соли при взаимодействии с основаниями проявляют кислые свойства.
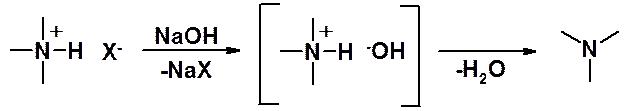
При низкой температуре (-60о) гидроксид протонной соли устойчив, при комнатной он теряет воду, превращаясь в амин.
Четвертичные алкильные соли при взаимодействии с водными растворами щелочей превращаются в гидрооксиды тетраалкиламмония, которые весьма устойчивы.
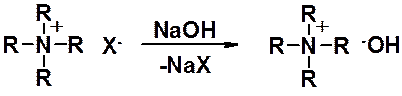
Эти соединения в растворе полностью ионизованы и обладают основностью сравнимой с едкими щелочами. Часто гидрооксиды тетраалкиламмония используют в качестве оснований в органическом синтезе. Так, тетрабутиламмоний гидроксид прекрасно растворим в неполярных органических растворителях (в отличие от гидроксидов щелочных металлов) и, например, может быть использован для создания щелочной среды при проведении реакции в растворе бензола или других неполярных расоворителях.
При высокой температуре в присутствии щелочей происходит расщепление четвертичных гидроксидов с образованием третичных аминов и алкенов (Гофмановское расщепление).
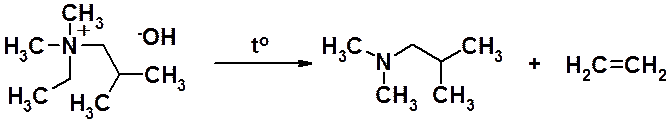
Если атом азота связан с различными заместителями, алкен образуется из заместителя с наименьшим числом атомов углерода (правило Гофмана).
Сравнение основности алифатических аминов с аммиаком показывает, что она изменяется в следующей последовательности:
аммиак < первичный < вторичный > третичный.
Относительная основность аммиака и алифатических аминов
|
Формула |
Относительная основность |
|
NH3 |
1 |
|
C2H5NH2 |
20 |
|
(C2H5)2NH |
57 |
|
(C2H5)3N |
33 |
Действие донорных алкильных групп увеличивает электронную плотность на атоме азота, повышая основность. Понижение основных свойств у триэтиламина объясняется стерическими препятствиями.
Ароматические амины заметно более слабые основания, чем аммиак и алифатические производные. Анилин примерно на шесть порядков, а дифениламин на десять порядков более слабые основания, чем алкиламины. Причина в сопряжении свободной пары электронов атома азота с ароматической шестеркой.

Пара электронов азота частично втянута в кольцо и мене доступна для взаимодействия с протоном.
Первичные и вторичные амины способны отдавать протон суперсильным основаниям с образованием амидного аниона. В качестве оснований могут быть использованы щелочные металлы или их гидриды.
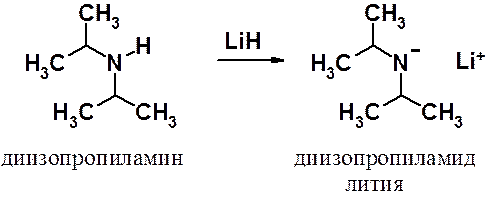
По основности, образующиеся амиды, уступают только гидридам щелочных металлов. Диизопропиламид лития одно из самых сильных оснований, известных химикам-органикам.
Амины легко вступают в реакции алкилирование (см. выше алкилирование по Гофману) и ацилирования (см. в разделе «Карбоновые кислоты» получение амидов). Реакции с карбонильными соединениями см. в соответствующем разделе.
Основные данные об активирующих и ориентирующих свойства аминогруппы, связанной с бензольным кольцом, рассмотрены в Разделе «Бензол». Особенности реакций SEAr рассмотрены здесь.
Аминогруппа так сильно активирует кольцо, что бромирование протекает без катализатора, а реакция останавливается только когда все орто- и пара-положения заняты галогенами.
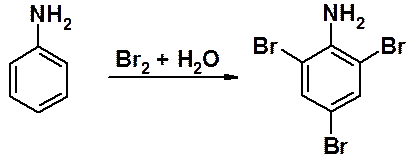
Для получения моногалогенопроизводного предварительно проводят ацилирование аминогруппы, превращая ее из амино- в амидную. Последняя обладает теми же ориентирующими свойствами, но выраженными в заметно меньшей степени. После проведения бромирования проводят гидролиз ацильной группы (снимают защиту), получая пара-броманилин, как основной продукт.
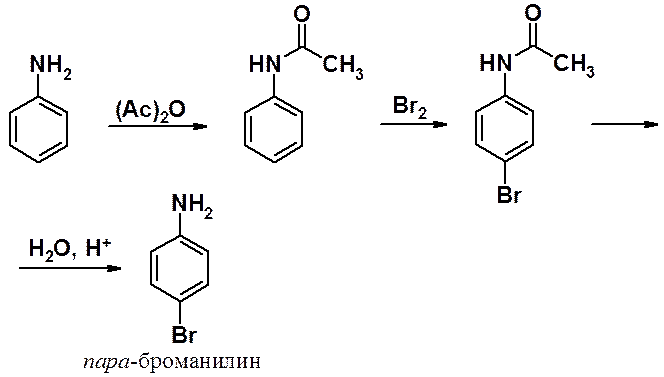
Нитрование самого анилина или ароматических аминов выполнить невозможно. Азотная кислота обладает сильными окислительными свойствами, а амины, как все вещества богатые электронами, склонны к окислению. В присутствии окислителей амины превращаются во множество различных продуктов, которые обычно не удается разделить и идентифицировать.
Для проведения нитрования используют ацильную защиту, превращая аминогруппу в амид. Затем проводят нитрование, после которого удаляют защитную группу. Защита реакционоспособной функциональной группы - стандартный прием в синтетической органической химии.
Классический пример: нитрование анилина. Действием уксусного ангидрида анилин превращают в ацетанилид. Нитрование ацетанилида при пониженной температуре приводит к смеси орто- и пара-нитроацетанилидов. Орто-изомер гидролизуется в значительно более мягких условиях, чем пара-. После первой стадии гидролиза выделяют орто-нитроанилин. Затем проводят кислый гидролиз ацетильной группы в пара-нитроацетанилиде, получая пара-нитроанилин.
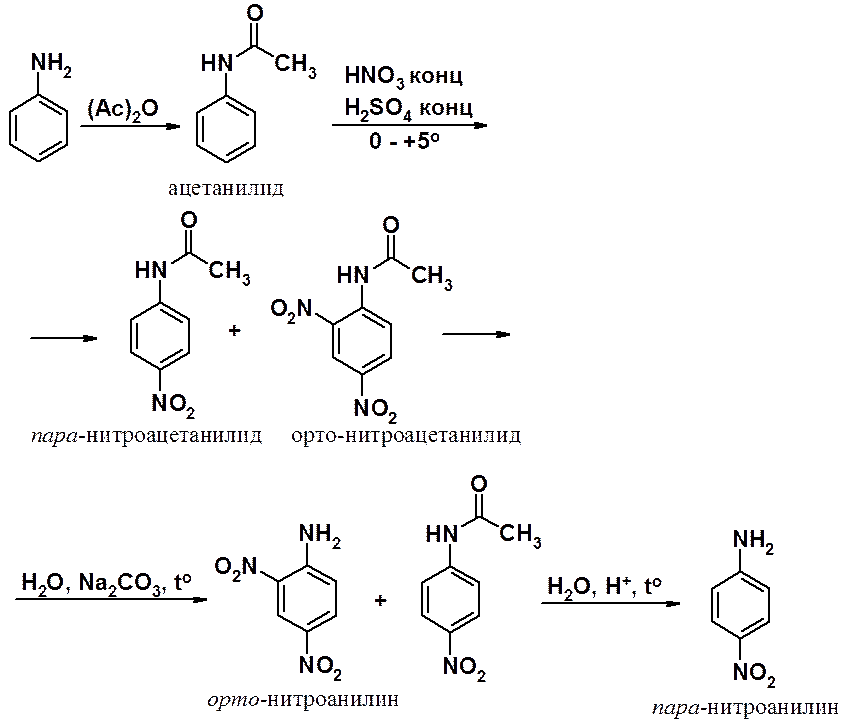
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.