Наиболее интересны гетероароматические соединения, свойства которых коренным образом отличаются от их углеводородных аналогов. Среди гетероароматических веществ наибольшее значение принадлежит пяти- и шестичленным гетероциклам, содержащих атомы азота, кислорода и серы.
Номенклатура гетероциклов очень сложна. Кроме того, в этом классе черзвычайно часто используют тривиальные названия, которые надо запомнить.
Можно отметить следующее:
· природу гетероатома указывают приставками окса-, тиа- и аза- для O, S и N гетероатомов соответственно;
· если в цикле несколько гетероатомов, их перечисляют в порядке старшинства S > O > N;
· нумерацию кольца всегда начинают со старшего гетероатома и выполняют так, чтобы сумма позиций гетероатомов была минимальна;
· пятичленные системы, имеющие в качестве гетероатома азот, называют азолами, шестичленные – азинами.
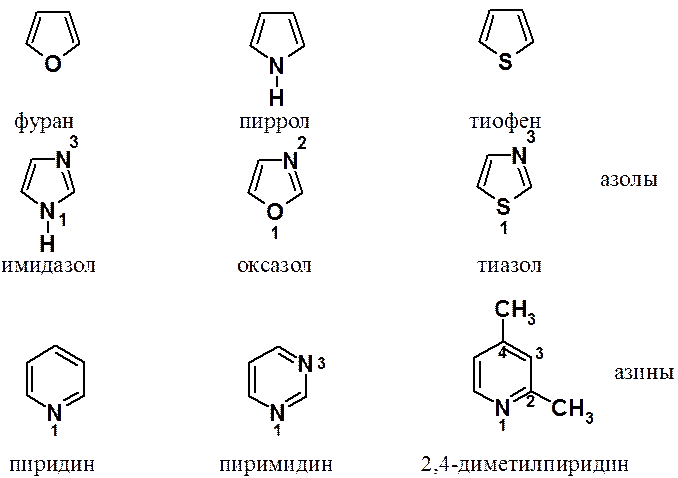
Обычные структурные формулы фурана, пиррола и тиофена указывают на гетеродиеновый характер этих соединений.
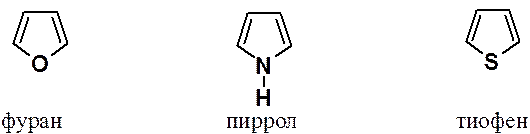
Однако эти гетероциклы в общем не обладают ожидаемыми свойствами. Например, пиррол не проявляет основных свойств, а тиофен не оксисляется, как это характерно для сульфидов.
Зато фуран, пиррол и тиофен вступают в реакции электрофильного замещения (нитрование, сульфирование, галогенирование, ацилирование по Фриделю-Крафтсу, реакцию Раймера-Тимана) характерные для ароматических систем.
Рассмотрим строение этих молекул.
Каждый атом цикла связан с соседними тремя s-связями, образованными за счет sp2-гибридных орбиталей, лежащих в одной плоскости. У атомов углерода остается по одному p-электрону, а у гетероатома – элетронная пара р-орбитали. Перекрывание четырех р-электронов углеродных атомов и пары р-электронов гетероатома приводит к возникновению тороидальных p-облаков над и под плоскостью цикла (см. рис. 42.1.). p-Электронные тороидальные облака содержат 6 p-электронов (как в бензоле).
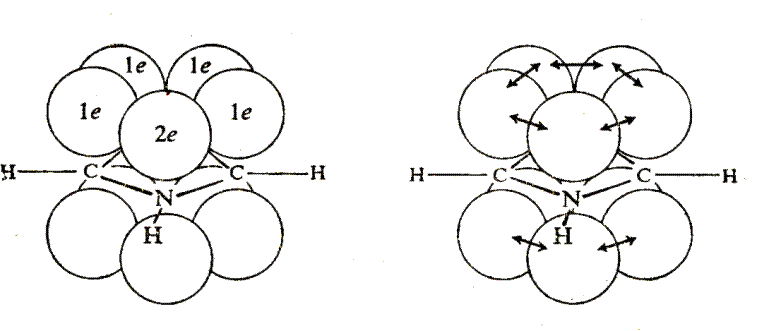 |
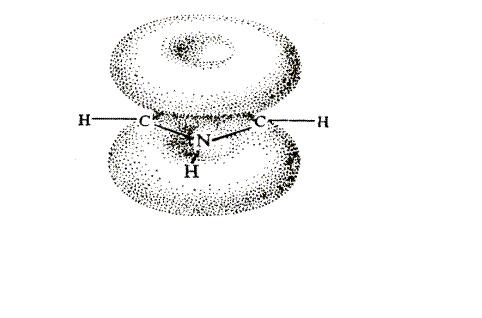
Рис. 42.1. Молекула пятичленного гетероароматического соединения
Делокализация стабилизирует молекулу. Она может быть показана также с помощью граничных структур.
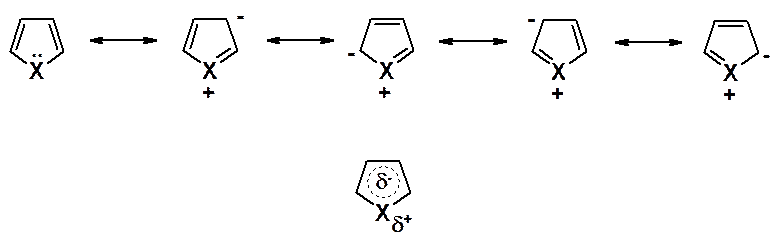
Электроны гетероатома частично втянуты в гетероцикл, он позитивирован – молекулы обладают дипольным моментом.
Энергия делокализации пятичленных гетероароматических соединений находится в диапазоне 22-28 ккал/моль (самая низкая у фурана, самая высокая у тиофена). Такой выигрыш в энергии заметно меньше, чем у производных бензола (36 ккал/моль), но намного больше, чем у сопряженных диенов (около 3 ккал/моль). Различия в ароматичности пятичленных гетероциклов объясняются различной способностью гетероатомов удерживать около себя электроны. Чем сильнее атом удерживает электроны, тем меньше их делокализация и, следовательно, выигрыш в энергии.
Такое распределение электронной плотности приводит к важным результатам. Гетероатом пиррола не обладает основными свойствами – пара электронов сопряжена. NH-Группа пиррола проявляет слабокислые свойства. Говорят о пиррольном атоме азота – азоте проявляющие свойства аналогичные пирролу. В целом пиррольный атом азота по своим кислотно-основным свойствам больше всего напоминает амидный азот.
Общий метод получения – циклизация g-дикарбонильных соединений. Обычно так получают 2,5-дизамещенные производные.
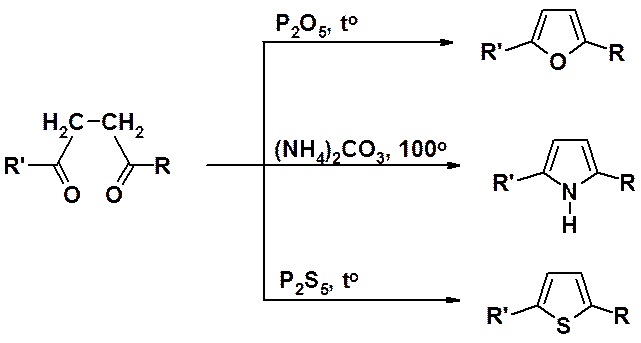
Незамещенный фуран обычно получают из фурфурола. Получение фурфурола основано на гидролизе полипентозанов – материалов богатых пентозами (отруби, кочерыжки кукурузы и т.п.). В результате гидролиза горячей кислотой образуются пентозы, которые далее циклизуются и дегидратируются.
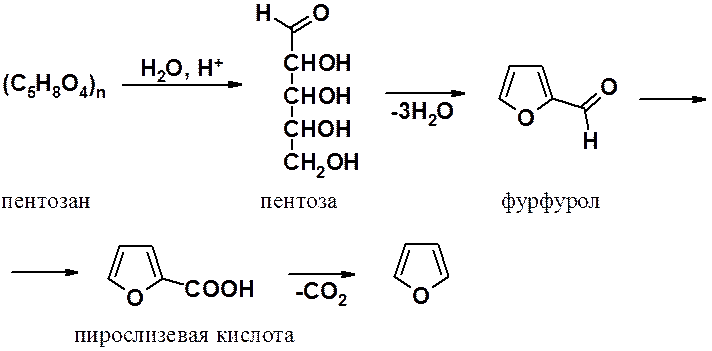
Пиррол и тиофен содержатся в каменноугольной смоле, откуда их и добывают.
Пиррол может быть синтезирован циклизацией с одновременным аминированием ацетиленового спирта, получаемого по реакции Репе.
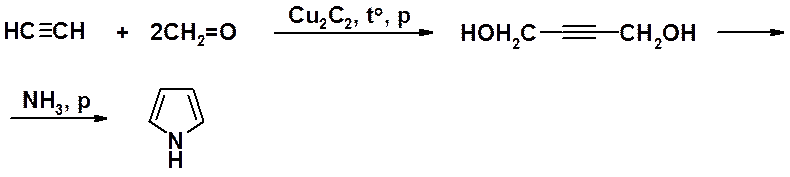
Синтетический тиофен получают реакцией элементарной серы с н-бутаном при высокой температуре.
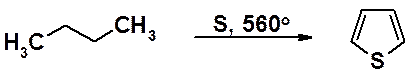
В присутствии оксида алюминия при высокой температуре фуран, пиррол и тиофен способны превращаться друг в друга (так называемый «треугольник Юрьева»).
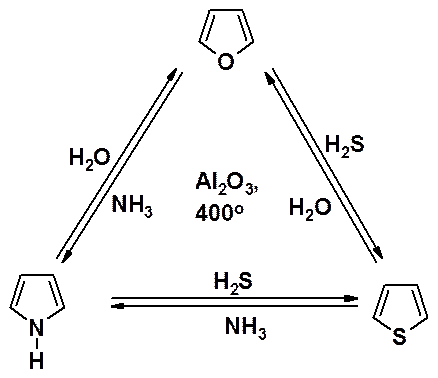
· Фуран. Реакция с малеиновым ангидридом. Ацидофобность. Реакции электрофильного замещения. p-Избыточность. Фурфурол, получение и свойства. Производные нитрофурана.
· Пиррол. Ацидофобность пиррола. Реакции электрофильного замещения по NН-группе. Пиррольный цикл как структурный элемент природных соединений. Порфин, образование хелатных комплексов. Понятие о порфиринах (гем, хлорофилл). Витамин В12.
· Тиофен. Реакции электрофильного замещения (сравнить с бензолом).
Фуран – самый неароматичный в ряду пятичленных гетероароматических соединений – проявляет свойства гетеродиена.
Он легко вступает в реакцию Дильса-Альдера с малеиновым ангидридом превращаясь в тетрациклический аддукт.
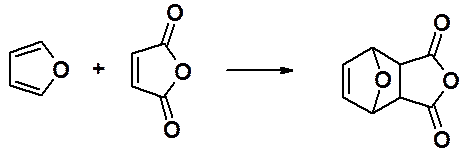
При пропускании смеси фурана с воздухом над оксидом ванадия (V) при 300о происходит окисление гетероцикла до малеинового ангидрида.
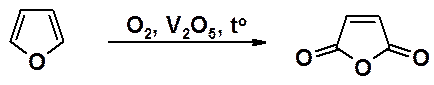
Несколько меньший диеновый характер проявляет пиррол. Он вступает в реакцию с малеиновым ангидридом, но образует продукт замещения, а не аддукт реакции Дильса-Альдера.
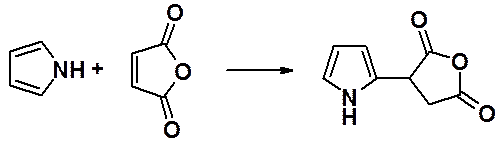
Диеновые свойства пиррол демонстрирует только в реакции восстановления водородом в момент выделения и при взаимодействии с трифенилметильным радикалом.
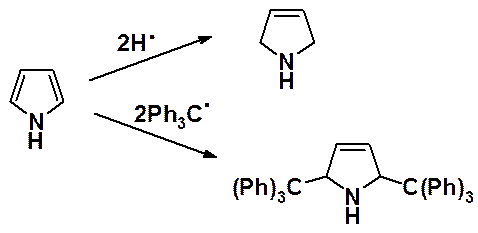
В нейтральной и основной средах фуран очень устойчив. В присутствии кислот происходит протонирование атома кислорода, которое приводит к разрыву в цепи сопряжения. В кислой среде фуран быстро полимеризуется с окислением, давая сложные смеси неразделяемых продуктов. Говорят, что фуран «ацидофобное» вещество.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.