Сульфирование ароматических аминов, как все реакции сульфирования, отличаются от других реакций SEAr.
Взаимодействие серной кислоты с анилином на холоду приводит к гидросульфату анилиния. Реакция в кольцо не происходит из-за образования сильно акцепторной дезактивирующей аммонийной группы. Незначительное нагревание гидросульфата анилиния приводит с фенилсульфаминовой кислоте, которая при длительном нагревании при 200о превращается в пара-аминобензолсульфониевую (сульфаниловую) кислоту.
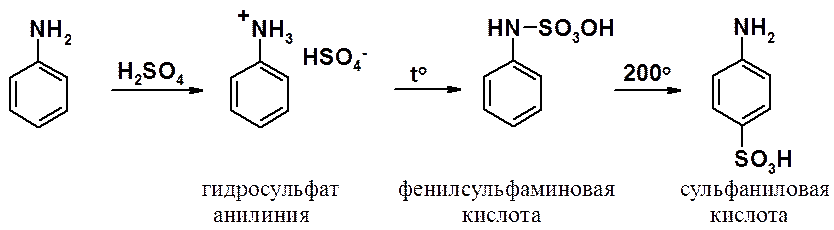
В зависимости от строения ароматического амина образуются разные продукты.
Первичные ароматические амины в реакции с азотистой кислотой образуют диазосоединения (см. следующий раздел).
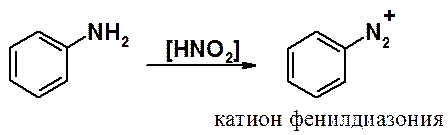
Вторичные ароматические амины в реакции с азотистой кислотой образуют N-нитрозопроизводные.
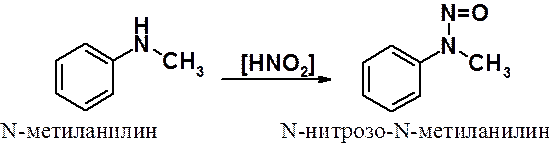
Третичные ароматические амины вступают с азотистой кислотой в реакцию ароматического электрофильного замещения с образованием пара-нитрозопроизводных.
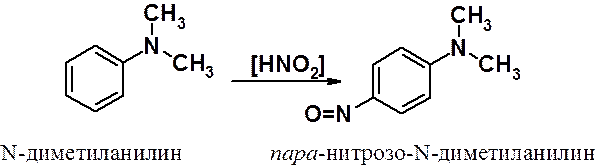
· Реакция диазотирования первичных ароматических аминов: условия ее проведения, механизм, нитрозоний-катион. Электронное строение солей диазония, устойчивые формы и превращения различных форм диазосоединений. Участие катиона диазония в кислотно-основных равновесиях.
· Реакции солей диазония, протекающие с выделением азота. Замещение диазогруппы на галоген, гидрокси- и алкоксигруппы, водород, циано-, родано- и нитрогруппу (реакции Зандмайера, Гаттермана, Шимана). Различия в механизмах этих реакций. Реакции, протекающие без выделения азота: получение арилгидразинов и азосочетание (SEAr). Азо- и диазосоставляющие. Ограничения реакции азосочетания и условия ее проведения в зависимости от природы азосоставляющией.
· Азокрасители. Электронное строение и особенности структуры. Метилоранж (синтез и индикаторные свойства).
Реакция диазотирования первичных ароматических аминов азотистой кислотой открыта П. Гриссом в 1858 г.
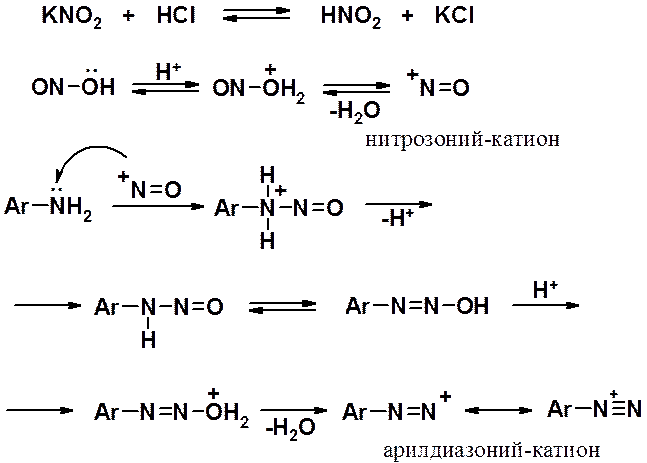
Реакцию диазотирования всегда проводят при пониженной температуре (0 - +5о) в связи с высокой реакционной способностью образующихся продуктов. Соли диазония представляют собой твердые вещества. В индивидуальном виде их выделяют крайне редко, поскольку в твердом виде они очень взрывоопасны. Поэтому, после проведения реакции диазотирования полученный раствор соли арилдиазония используют в дальнейших превращениях для получения самых разных ароматических соединений.
В реакции с алифатическими аминами не удается получить соль диазония, поскольку по мере образования она тут же превращается в спирт.
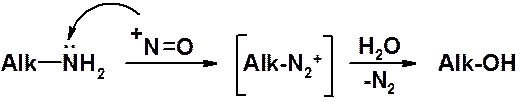
Соли диазония при подщелачивании превращаются в диазокислоты, а затем в их соли. При подкислении протекает обратная реакция.
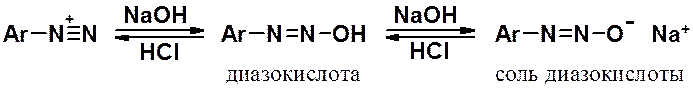
Наиболее важны среди диазосоединений соли диазония, реакции которых делят на две большие группы:
· реакции с выделением азота;
· реакции без выделения азота.
Использование солей диазония открывает путь синтеза широкого круга ароматических соединений, которые часто сложно или даже невозможно получить другими способами.
В самом общем виде эта группа реакций может быть представлена схемой:
![]()
Хотя все реакции солей диазония с выделением азота внешне очень похожи, они протекают по различным механизмам (с гетеролитическим или гомолитическим разрывом связи С-N), что требует глубокого понимания внутренней сущности процессов.
Если полученный раствор соли диазония выдержать некоторое время при комнатной температуре или слегка нагреть – произойдет превращение диазопроизводного в фенол. Реакция легко контролируется по выделению газообразного азота.
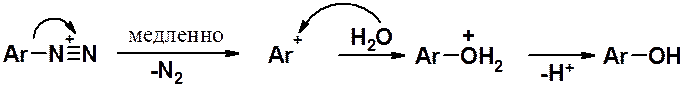
Введение в ароматическую молекулу OR-группы аналогично замещению на ОН-группу. Эта реакция может осложняться побочным процессом, протекающим по гомолитическому механизму, - замещением диазогруппы на водород.
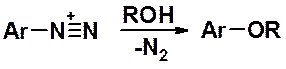
Наличие в цикле донорных заместителей благоприятствует замещению на алкокси-группу, акцепторных – замещению на водород. В сильно кислой среде образуются эфиры фенолов, в слабокислой – продукты замещения на водород.
Замещение диазогруппы на атом водорода проходит по гомолитическому механизму. Как правило, в эту сторону реакцию сдвигает применение ацетата натрия в уксусной кислоте (ацетатного буфера). Ацетат-анион образует с катионам диазония малоионизованные соединения, которые разлагаются на свободные радикалы.
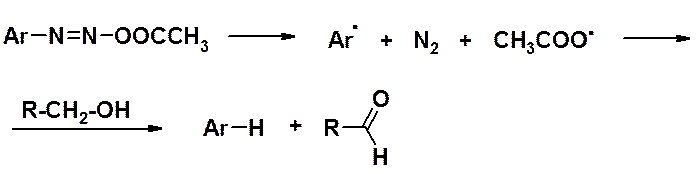
Замещение диазогруппы на атом водорода – синтетический прием, позволяющий удалить эту группировку из бензольного кольца. Поскольку соли диазония получают из аминов, а амины – из нитросоединений – это метод удаления нитро- и аминогрупп.
Существует более удобный метод замещения диазогруппы на водород, в котором отсутствуют конкурирующие реакции. Соль диазония получают из первичного амина с использованием форсорноватистой кислоты (H3PO2), а затем полученный раствор диазосоединения слегка нагревают, получая продукт замещения.
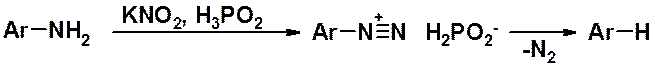
Применение солей диазония позволяет ввести в ароматический цикл любой атом галогена. Таким способом получают даже малодоступные фтор- и йодпроизводные.
Обработка диазониевой соли хлоридом или бромидом одновалентной меди приводит к замещению диазогруппы, соответственно, на хлор или бром. Реакция идет по гомолитическому механизму.
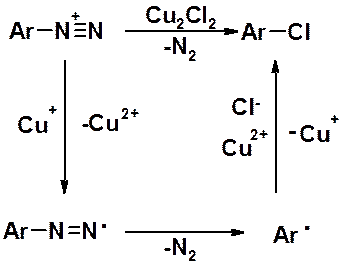
Вместо хлорида или бромида одновалентной меди можно использовать свежеприготовленный порошок металлической меди и соответствующую галогеноводородную кислоту. Это реакция Гаттермана, которая также проходит по гомолитическому механизму.
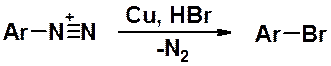
Йодирование протекает очень просто – раствор соли диазония обрабатывают раствором йодистого калия. Это один из немногих методов получения ароматических йодпроизводных.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.