Сам по себе механизм аналогичен восстановлению в кислой среде. Принципиально отличие состоит в том, что в этом варианте восстановление протекает медленно и долгоживущие промежуточные продукты могут быть выделены на любой стадии синтеза.
Важно: реакцию можно остановить на любой стадии и выделить любой промежуточный продукт (нитрозо-, гидроксиламино-, азокси-, азо-, гидразопроизводные)!
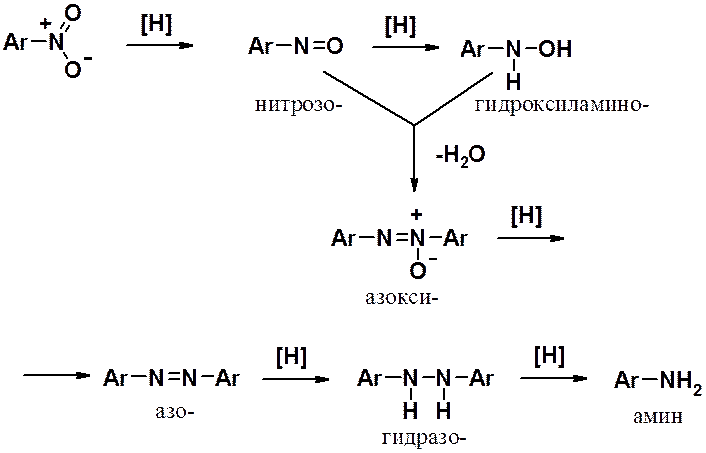
Если нужно получить амин – восстановление ведут в кислой среде. Чаще всего в щелочной среде проводят восстановление нитросоединений для получения одного из промежуточных продуктов.
В полинитросоединениях указанными выше методами восстанавливаются все нитрогруппы. Парциальное (частичное) восстановление возможно при использовании слабого восстановителя – сульфида аммония.
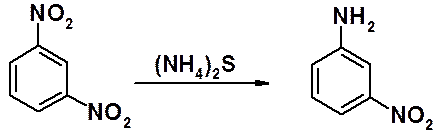
Вторая нитрогруппа сульфидом аммония не восстанавливается.
Электроноакцепторные свойства нитрогруппы приводят к подвижности водородов в a-положении.
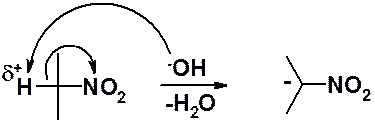
Кислые свойства проявляют только те соединения, в которых нитрогруппа связана с первичным или вторичным sp3-углеродом.
При подкислении солей нитросоединений следует ожидать протекания обратной реакции образования нейтрального нитропроизводного. Однако образуется вещество, обладающее намного большей кислотностью, чем нитросоединение. Этот факт объясняется делокализацией отрицательного заряда в анионе.
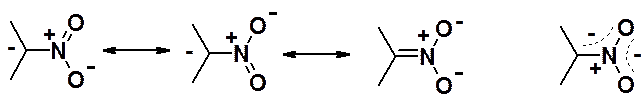
При подкислении соли протон может присоединиться к атому углерода или к атому кислорода с образованием таутомеров.
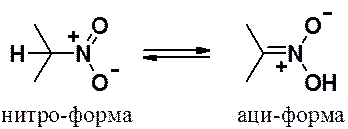
Такой вид таутомерии называют аци-нитро-таутомерия. В нейтральной и кислой средах равновесие сдвинуто в сторону нитро-формы, в щелочной среде (в солях) – в сторону аци-формы. Аци-формы нитросоединений называют нитроновыми кислотами, а их соли – нитронатами.
Классический случай аци-нитро-таутомерии наблюдается для фенилнитрометана.
При подкислении натровой соли фенилнитрометана аци-форма (фенилнитроновая кислота) выпадает в осадок, медленно (в течение нескольких часов) превращаясь в нитро-форму (фенилнитрометан).
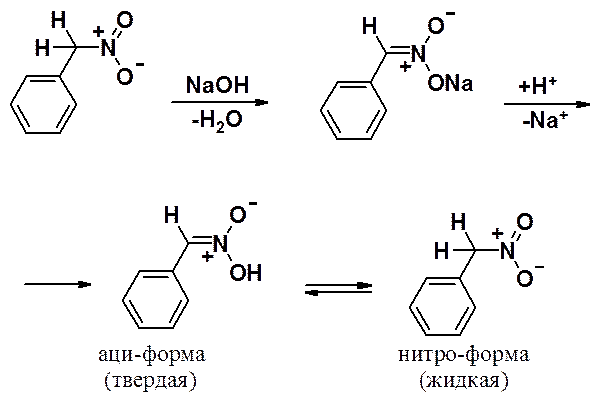
Подвижность водорода в a-положении к нитрогруппе широко используется в органическом синтезе.
Так, разложение натровых солей аци-формы нитросоединений избытком холодной минеральной кислоты приводит к карбонильным соединениям.
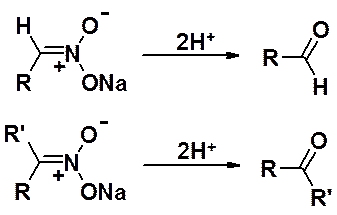
Первичные нитроновые кислоты при обработке 85% серной кислотой превращаются в гидроксамовые кислоты, гидролизующиеся в карбоновые кислоты (метод получения карбоновых кислот).
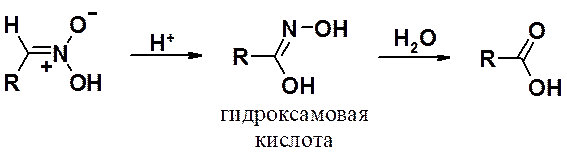
Соли нитросоединений (но не сами нитросоединения) мгновенно реагируют с бромом с образованием a-бромопроизводных. Первичные нитросоединения в этих условиях образуют дибром-, а нитрометан – трибромпроизводные.
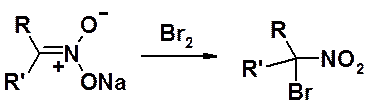
Реакция с азотистой кислотой может быть использована для качественного определения первичных, вторичных и третичных нитросоединений.
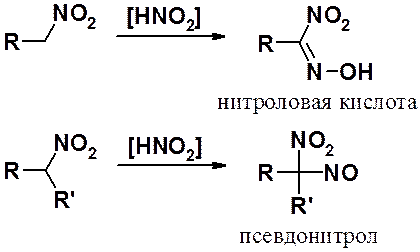
Третичные производные в реакцию не вступают. Псевдонитролы окрашивают растворы в синий, а соли нитроловых кислот – в красный цвет.
Образование в щелочной среде анионов нитросоединений, обладающих высокой нуклеофильностью, используется в конденсациях с карбонильными соединениями. В основном используют альдегиды и кетоны не способные участвовать в альдольной конденсации.
Часто, но не обязательно, конденсация сопровождается дегидратацией с образованием непредельных нитросоединений.
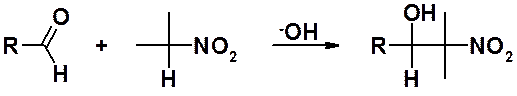
Реакция нитрометана с формальдегидом протекает с замещением всех водородов метильной группы, приводя к триметилолнитрометану.
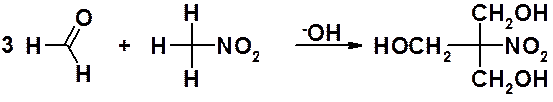
· Алифатические амины. Классификация, изомерия, номенклатура. Электронное и пространственное строение аминогруппы, зависимость от природы связанного с аминогруппой радикала.
· Методы получения: алкилирование аммиака и аминов по Гофману, восстановление нитросоединений (реакция Зинина), азотсодержащих производных карбонильных соединений, из амидов карбоновых кислот (перегруппировка Гофмана), фталимидный синтез (реакция Габриэля).
· Химические свойства. Основность и ее зависимость от природы углеводородного радикала. Реакции с электрофилами: алкилирование, ацилирование, нитрозирование. Четвертичные аммонийные производные и их соли: получение, электронное строение, химические свойства. Реакции разложения с образованим олефинов (Гофмановское расщепление).
· Ароматические амины. Основность (в сравнении с алифатическими аминами). Особенности реакции сульфирования и алкилирования ароматических аминов. Ацилирование ароматических аминов и использование ацильной защиты в органическом синтезе. Реакции с азотистой кислотой.
Амины рассматривают как производные аммиака, в котором один, два или три атома водорода замещены углеводородными радикалами.
Классификация аминов принципиально отличается от всех классов органических соединений. Амины классифицируют не по атому углерода, с которым связан азот аминогруппы, а по числу атомов водорода в аммиаке, замещенных органическими остатками. Они могут быть алифатическими, ароматическими и смешанными.
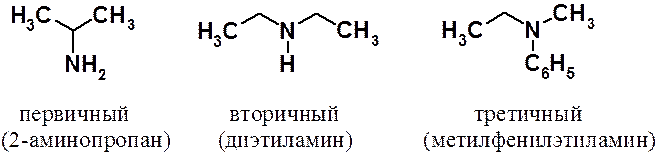
Кроме того, существуют аммонийные производные, которые подразделяют на протонные и четвертичные.
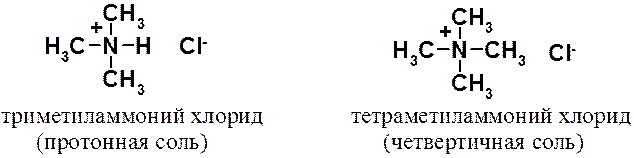
Ранее были рассмотрены методы получения аминов:
· восстановлением нитросоединений (в основном для получения ароматических аминов);
· нуклеофильным замещением галогена на аминогруппу в активированных акцепторами галогеноаренах;
· замещением галогена в галогеноаренах по ариновому механизму;
· нуклеофильным замещением галогена в альфатическом ряду (SN1 и SN2);
· перегруппировкой Гофмана амидов карбоновых кислот;
· восстановлением азотсодержащих производных карбонильных соединений;
· восстановлением нитрилов.
Проще всего этими методами получать первичные амины. Поскольку амины обладают нуклеофильными свойствами, часто вторичные и третичные производные получают алкилированием аминов (Гофмановское алкилирование).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.