Сульфонилхлориды могут быть получены:
· реакцией сульфохлорирования алканов (см. «Алканы»);
· из сульфокислот и пятихлористого фосфора;
· хлорсульфированием.
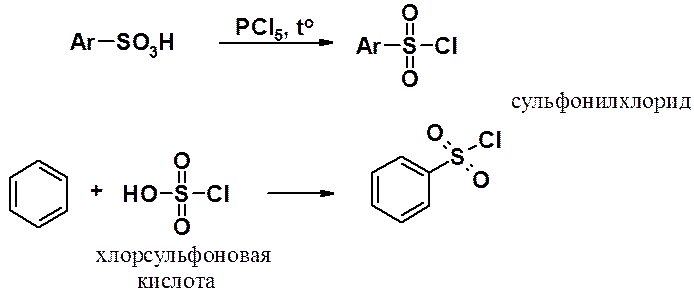
Атом хлора в молекуле сульфонилхлорида весьма подвижен, что используют для получения эфиров и амидов ароматических сульфокислот.
Эфиры сульфокислот получают в реакциях сульфонилхлоридов со спиртами в присутствии оснований, используемых как акцепторы хлористого водорода.
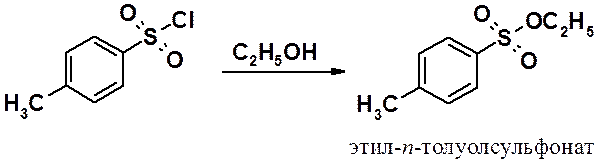
Эфиры сульфокислот используют в синтезе в качестве алкилирующих агентов.
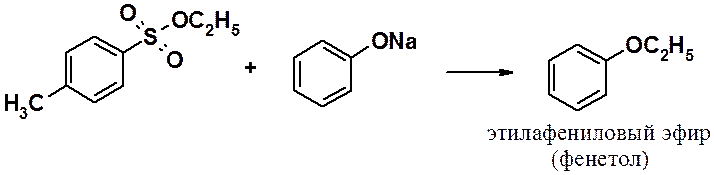
Сульфонамиды получают реакцией сульфонилхлорида с аммиаком, первичными или вторичными аминами. Образуются незамещенные, монозамещенные или дизамещенные сульфонамиды, соответственно.
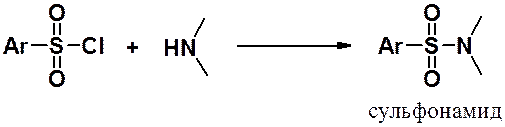
Сульфамиды с трудом подвергаются гидролизу, который протекает только в сильно кислой или щелочной среде. Их кислые свойства выражены значительно сильнее, чем у карбамидов. Сульфамиды образуют соли в реакциях со щелочами и совсем не проявляют основные свойства.
Сульфонамиды имеют большое значение в медицине – сульфаниламидные (сульфамидные) препараты – первые действенные средства против бактериальных инфекций.
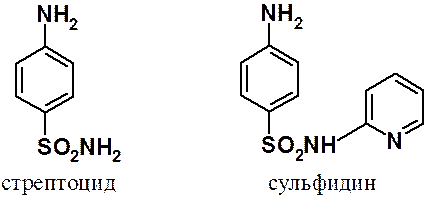
Первый открытый сульфаниламидный препарат – стрептоцид. Перед войной в Уральском политехническом институте И.Я. Постовским и сотрудниками синтезирован первый отечественный сульфаниламидный препарат – сульфидин. Сразу после начала Отечественной войны И.Я Постовским и Н.П. Беднягиной был налажен его выпуск на площадях Свердловского химфармзавода. Таким образом, ученые нашего университета спасли сотни тысяч раненых.
В щелочной среде водороды N-амидной группы сульфамидов легко замещаются на хлор с образованием, обладающих сильными окислительными свойствами. Многие хлорамиды используются в качестве дезинфицирующих веществ.
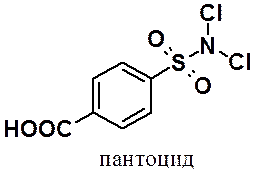
N-Натровую соль имида о-сульфобензойной кислоты используют в качестве заменителя сахара (сахарин). Сахарин в 500 раз слаще сахара и без изменений выводится почками из организма.
Нитросоединениями называют вещества в молекуле которых есть NO2-группа, причем атом углерода связан с атомом азота (C-NO2 - нитросоединения, С-O-N=O – эфиры азотистой кислоты). Их делят на класса - алифатические и ароматические нитросоединения. Первые могут быть первичными, вторичными или третичными.
Атом азота может группировать около себя не более 8 электронов, т.е. образовывать не более четырех ковалентных связей.
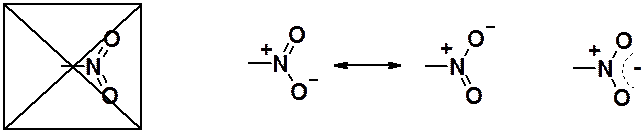
Обычно считается, что с одним кислородом азот связан двойной связью, с другим – семиполярной. Такая формула не отражает реальное положение дел. РСА показывает, что расстояния между атомом азота и обоими кислородами одинаковы. Это говорит о том, что в нитрогруппе нет ни двойной, ни координационной связей (см. граничные структуры). Четыре p-электрона равномерно распределены по трем атомам (суперпозиция граничных структур).
Реакции нитрования алканов и ароматических соединений были подробно рассмотрены в соответствующих разделах.
Классический лабораторный метод получения нитросоединений – замещение галогена на нитрогруппу.
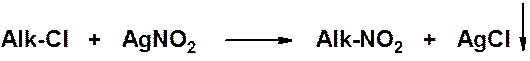
Труднодоступные ароматические нитросоединения могут быть получены из солей диазония (см. далее раздел «Диазосоединения»).
![]()
Нитрометан получают не нитрованием метана, а замещением хлора в монохлоруксусной кислоте на нитрогруппу. Образующаяся нитроуксусная кислота мгновенно декарбоксилируется в целевой продукт.
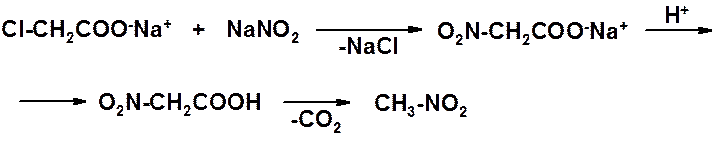
Непредельные нитросоединения нельзя получить непосредственным нитрование или замещением галогена на нитрогруппу. Для их синтеза, сначала получают b-нитроспирты, которые дегидратируют с получением непредельных нитросоединений.
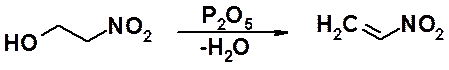
· Восстановление (каталитическое, в кислой и щелочной средах). Частичное восстановление полинитроароматических соединений. СН-Кислотность и связанные с ней реакции: конденсации с карбонильными соединениями, нитрозирование (использование этой реакции для определения типа нитросоединения), галогенирование. Аци-нитро-таутомерия, мезомерный анион, восстановление в гидроксамовые кислоты, превращения в карбонильные соединения и кислоты.
Возможно, самая важная реакция нитросоединений – восстановление, в одну стадию приводящая к первичным аминам.
Восстановление нитросоединений – основной метод получения ароматических аминов. В алифатическом ряду этот способ обычно не используют, т.к. алифатические нитросоединения малодоступны. Алифатические амины получают иначе (см. раздел «Амины»).
Общая реакция восстановления нитросоединений:
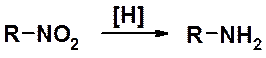
Известно три основных метода восстановления:
1. каталитическое гидрирование (катализаторы Pt, Pd, Ni) – экологически чистый, но дорогой метод;
2. восстановление в кислой среде (Зинин, 1842 г.) – используют металлы (Fe, Zn, Sn или их соли) и, чаще всего, соляную кислоту;
3. восстановление в щелочной среде – используют амфотерный металл (Sn).
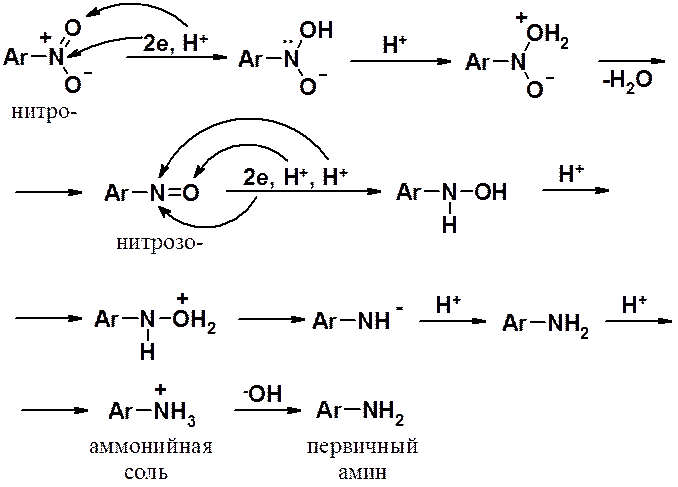
Реакция начинается с переноса протона на атом кислорода и пары электронов на атом азота нитрогруппы. Определяющим является перенос электронной пары (просто в кислоте реакция не идет!). В ходе восстановления, промежуточно образуется нитрозопроизводное, которое аналогично нитросоединению восстанавливается до амина. Поскольку реакция проходит в кислой среде, образовавшийся амин можно выделить только в виде аммонийной соли. Для превращения последней в свободный амин, соль необходимо обработать щелочью
Важно: при восстановлении в кислой среде никакие промежуточные соединения выделить невозможно!
Реакция протекает очень быстро и останавливается только при образовании аммонийной соли, которую можно выделить в свободном виде, но чаще реакционную смесь подщелачивают, после чего выделяют амин в виде свободного основания.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.