Можно заметить, что введение даже одного атома хлора в молекулу уксусной кислоты увеличивает кислотность на два порядка, а трихлоруксусная кислота по силе сравнима с неорганическими производными.
Изменение кислотности при переходе от a- к g-масляной кислоте иллюстрирует высказанное ранее утверждение, что индуктивный эффект (и донорный и акцепторный) наиболее заметен на соседнем атоме. Чем дальше расположен атом хлора, тем меньшее влияние он оказывает на кислотность.
В ароматическом ряду стабильность карбоксилат-аниона повышена за счет сопряжения с ароматическим циклом. Так, бензойная кислота примерно в 3,6 раза сильнее уксусной. Акцепторы в положениях 2,4,6- бензольного кольца увеличивают кислотность, а доноры – уменьшают. Причем особенно сильно влияют заместители в положениях 2- и 6-, что вызвано их близостью к карбокси-группе. Например, пара-хлорбензойная кислота только 1,6 раза, в орто-хлорбензойная кислота в 19 раз сильнее бензойной.
· Химические свойства. Получение производных карбоновых кислот: солей, ангидридов, галогеноангидридов, сложных эфиров, амидов, нитрилов. Декарбоксилирование, восстановление и галогенирование кислот. Реакции замещения в кольце ароматических карбоновых кислот. Основные пути использования карбоновых кислот.
· Соли. Получение. Химические свойства: декарбоксилирование, анодный синтез Кольбе, получение карбонильных соединений.
· Ангидриды. Получение: дегидратация кислот с помощью Р2О5; ацилирование солей карбоновых кислот хлорангидридами. Химические свойства: реакции с нуклеофилами (ацилирование, этерификация).
· Хлорангидриды. Получение. Химические свойства: реакции с нуклеофилами (ацилирование, этерификация, взаимодействие с водой, аммиаком, аминами, фенолами), восстановление до альдегидов, реакции с магнийорганическими соединениями. Хлористый бензоил и реакции бензоилирования.
· Сложные эфиры. Получение: этерификация карбоновых кислот (механизм), ацилирование спиртов и их алкоголятов ацилгалогенидами и ангидридами, алкилирование карбоксилат-ионов. Химические свойства: гидролиз (механизм кислотного и основного катализа), переэтерификация; аммонолиз, каталитическое гидрирование, восстановление комплексными гидридами металлов и металлами в присутствии источников протонов.
Получение солей – простейшая реакция карбоновых кислот.
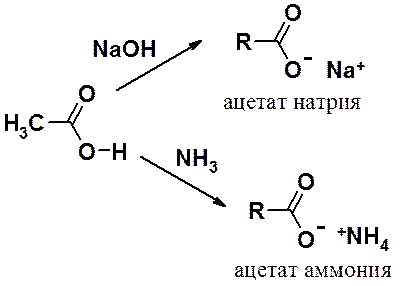
Получение углеводородов декарбоксилированием солей карбоновых кислот и анодным синтезом Кольбе рассмотрены в разделе «Алканы».
Ангидриды карбоновых кислот могут быть получены межмолекулярной дегидратацией или ацилированием карбоновых кислот хлорангидридами. Реакция ацилирования – введение ацильной группы (остатка карбоновой кислоты, но не альдегида).
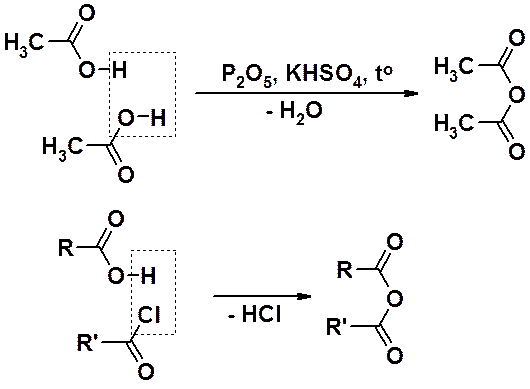
Первым способом получают симметричные, вторым – симметричные и несимметричные ангидриды.
Сами по себе ангидриды карбоновых кислот не вызывают особого химического интереса. Как и ангидриды любых кислот – ангидриды карбоновых кислот - скрытая и более реакционоспособная форма кислот. Часто их используют вместо кислот в реакциях ацилирования (см. далее).
Ангидриды легко гидролизуются водой до соответствующей кислоты.
Галогенангидриды (ацилгалогениды) – производные карбоновых кислот, в которых вместо ОН-группы атом галогена. В подавляющем большинстве случаев в молекуле присутствует атом хлора, значительно реже – бром, никогда - фтор. Когда говорят о галогенангидридах, почти всегда подразумевают хлорангидриды.
Хлорангидриды получают действием на кислоты галогенидов фосфора (PCl3, POCl3, PCl5) или хлористого тионила (SOCl2). Механизм реакций аналогичен описанному ранее замещению ОН-группы в спиртах на атом галогена.
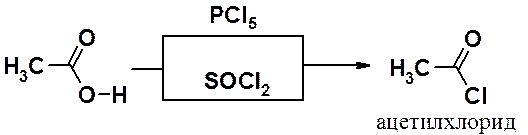
Устойчивость хлорангидридов муравьиной кислоты столь низка, что их получить не удается.
Хлорангидриды, как и ангидриды, используют в качестве реагентов во многих реакциях получения производных карбоновых кислот.
Взаимодействие карбоновых кислот со спиртами в присутствии минеральной кислоты (реакция этерификации) приводит к сложным эфирам.
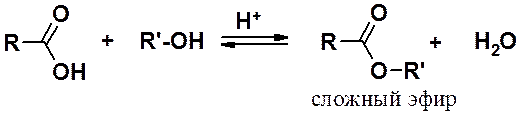
Механизм реакции этерификации:
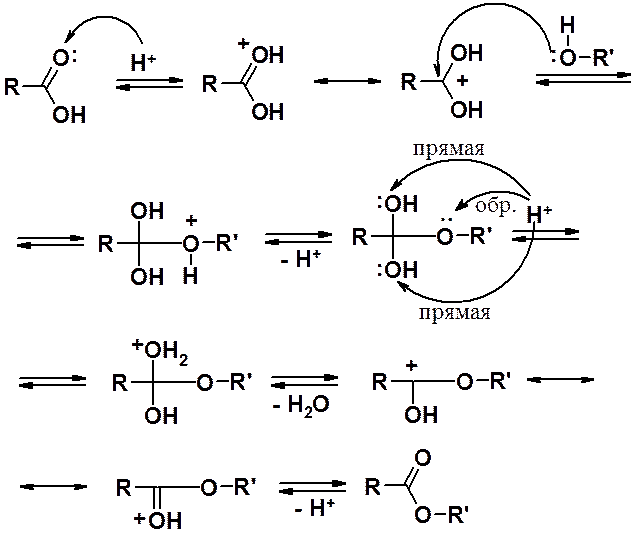
В образующемся нейтральном интермедиате скорости прямой и обратной реакций близки. В общем случае выходы в реакции не превышают 70% от теории. Для увеличения выхода обычно удаляют сложный эфир из сферы реакции.
Механизм реакции этерификации доказан с помощью изотопномеченного спирта.
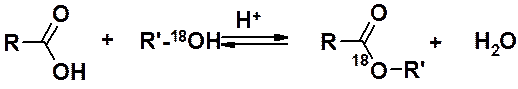
В воде изотопная метка не обнаружена. Следовательно, сложноэфирный кислород – из спирта.
Реакция этерификации полностью обратима. Обратная реакция - гидролиз (кислый или щелочной). Механизм кислого гидролиза показан выше.
Механизм гидролиза в присутствии щелочей (реакция омыления):
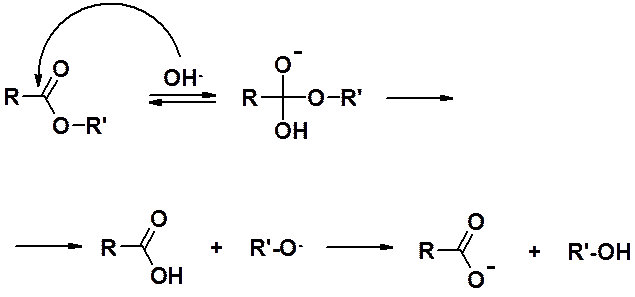
Кислый гидролиз, как и этерификация полностью обратим. Щелочной гидролиз приводит к получению соли карбоновой кислоты и поэтому необратим.
Сложные эфиры могут быть получены также и реакцией переэтерификации.
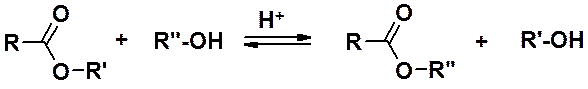
По механизму реакция переэтерификации очень похожа на гидролиз (вместо Н-ОН - R-ОН).
Поскольку реакция полностью обратима, ее проводят в большом избытке спирта (R”-OH), чтобы сдвинуть равновесие вправо. В некоторых случаях переэтерификация дает даже лучшие результаты, чем этерификация.
Достоинством этерификации и переэтерификации является простота реакции и доступность исходных веществ, недостатком - обратимость реакции. В необратимых реакциях получения сложных эфиров исходят из ангидридов или хлорангидридов карбоновых кислот.
Получение сложных эфиров из ангидридов.

Получение сложных эфиров из хлорангидридов.
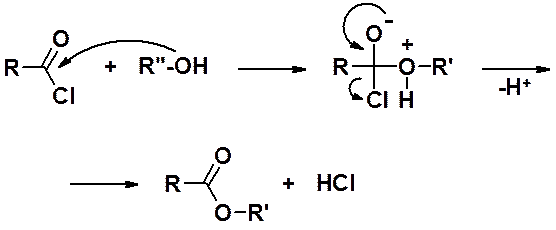
Все эти реакции можно рассматривать как ацилирование спиртов. Реакционная способность уменьшается в рядах:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.