Реакции с кислотами
Пиридин легко реагирует с минеральными кислотами, образуя протонные соли, которые под действием оснований превращаются в нейтральные пиридины.
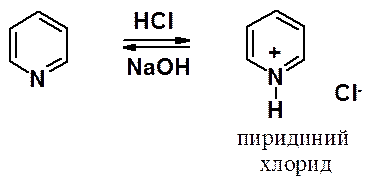
Реакции N-алкилирования (кватернизации)
При взаимодействии с алкилгалогенидами и другими алкилирующими агентами пиридин проявляет нуклеофильные свойства, образуя четвертичные соли.
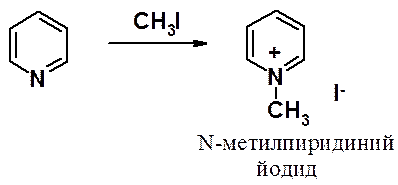
Реакция протекает по механизму SN2.
Реакции электрофильного замещения водорода
Реакции электрофильного замещения водорода типичны для соединений проявляющих ароматические свойства.
Электроноакцепторный пиридиновый атом азота не благоприятствует взаимодействию с электрофильными реагентами.
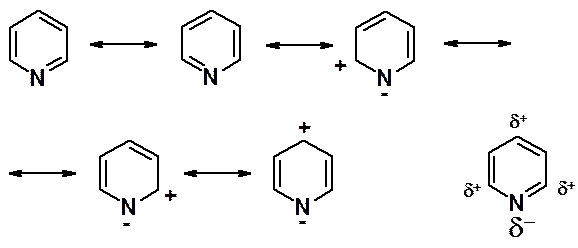
На азоте имеется избыток электронной плотности, на всех атомах углерода – недостаток. Особенно понижена электронная плотность в положениях a- и g-кольца. В реакциях электрофильного замещения пиридин ведет себя как сильно дезактивированный бензол. Реакции галогенирования, нитрования и сульфирования идут только в очень жестких условиях с низким выходом, а алкилирование и ацилирование по Фриделю-Крафтсу провести не удается. Входящая в цикл группа оказывается в положениях b- (3- или 5-), которые наименее обеднены электронами.
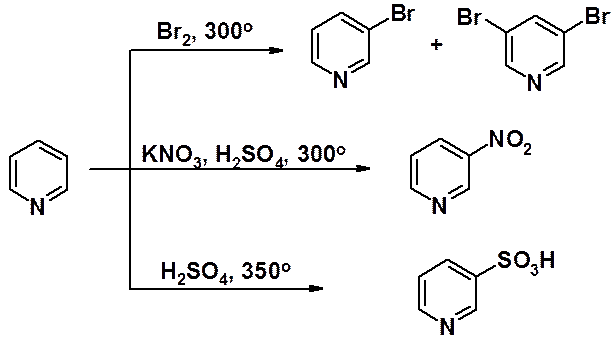
Для получения a- и g-замещенных пиридинов используют пиридин-N-оксиды, получаемые окислением гетероцикла пероксидом водорода в уксусной кислоте.
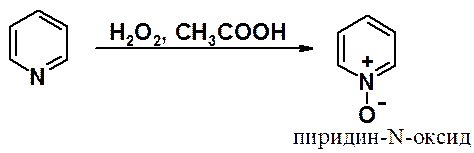
Глядя на структурную формулу пиридин-N-оксида создается впечатление, что появление в молекуле положительно заряженного атома азота (формально более акцепторного, чем азот нейтрального пиридина) отрицательно скажется на возможность участия такой системы в реакциях с электрофилами. Однако N-оксиды проявляют высокую активность в реакциях электрофильного замещения вследствие сопряжения ароматической шестерки с электронами атома кислорода.
В результате сопряжения в a- и g-положения N-окиси могут достаточно легко быть введены электрофильные заметители. При необходимости, после проведения реакции замещения проводят реакцию восстановления N-оксидной группы.
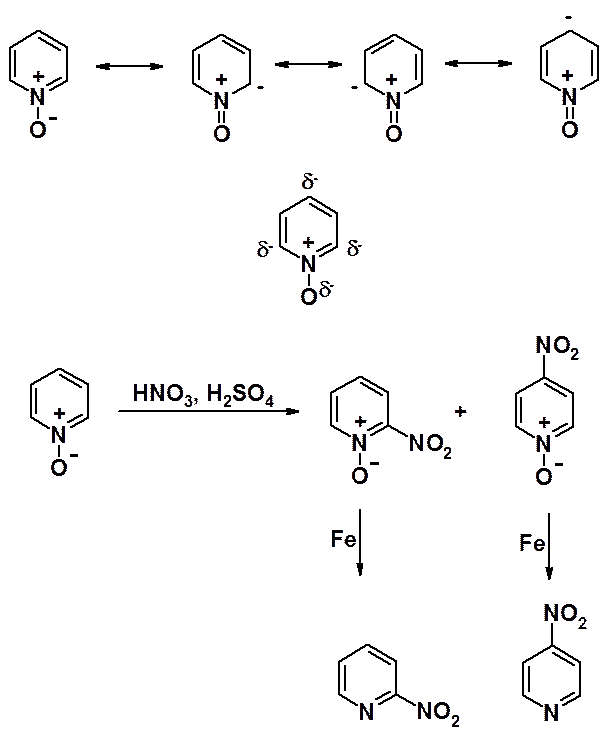
Реакции нуклеофильного замещения
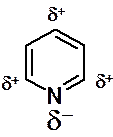
Заметный недостаток электронной плотности в положениях 2-, 4- и 6- пиридинового цикла указывает на возможность атаки этих углеродов нуклеофильными реагентами. Действительно для пиридина и всех шестичленных азотсодержащих гетероароматических соединений характерны реакции нуклеофильного замещения водорода – SNH.
В 1914 г. А.Е. Чичибабин взаимодействием пиридина с амидом натрия в кипящем ксилоле получил продукт реакции нуклеофильного замещения водорода (SNH) – 2-аминопиридин (реакция Чичибабина).
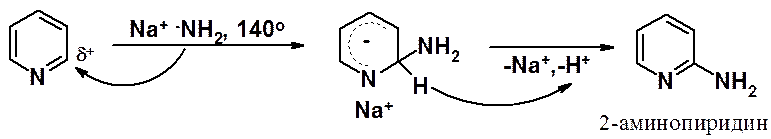
В этой реакции происходит замещение гидрид-иона (Н-), который является с энергетической точки зрения самой плохой уходящей группой. Не существует растворителей способных сольватировать и, следовательно, понижать энергию Н-. Реакции нуклеофильного замещения водорода всегда проходят в присутствии окислителя, превращающего гидрид-ион в воду. В качестве окислителя могут быть использованы KMnO4, Ac4Pb, элементарная сера и многие другие. Если в схеме реакции окислитель не указан, это означает, что окисление происходит действием кислорода воздуха.
Аналогичная реакция нуклеофильного замещения происходит при высокой температуре при взаимодействии пиридина со щелочами.

В 2(4,6)-амино- и 2(4,6)-гидроксипиридинах возможны соответственные таутомерии: амино-иминная и лактон-лактимная.
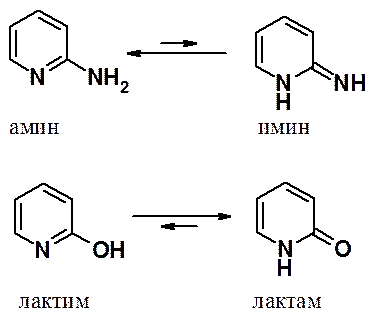
В аминопиридинах таутомерное равновесие полностью сдвинуто в сторону амино-формы, в гидроксипиридинах – в сторону кето-формы (лактамной).
3-Амино- и гидроксизамещенные пиридины в таутомерные превращения вступать не могут.
Из многих важных производных пиридина следует выделить никотиновую (фермент, витамин) и изоникотиновую (туберкулостатические препараты) кислоты.
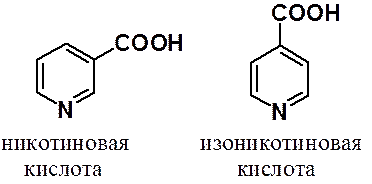
Моноциклические азины могут содержать до четырех атомов азота в цикле (от моно- до тетразинов).
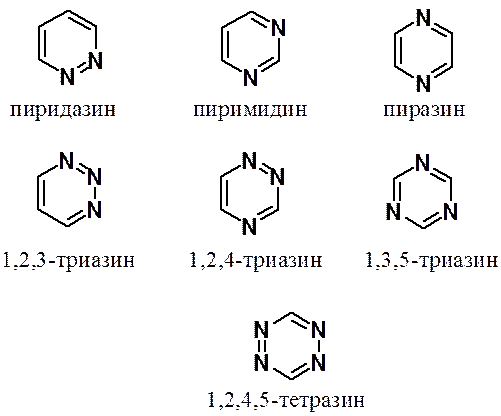
При увеличении числа атомов азота в цикле склонность к реакциям электрофильного замещения уменьшается (уже в ряду диазинов такие реакции не идут), а активность в реакциях нуклеофильного замещения растет.
Мощным средством активации азинов в реакциях нуклеофильного замещения является их кватернизация (превращение в четвертичную соль). Положительный заряд, формально находящийся на атоме азота, делокализован по всему кольцу уменьшая электронную плотность на атомах углерода и облегчая нуклеофильную атаку.
Так, аминирование пиридина происходит при температуре 140о, а аминирование N-метилпиридиниевой соли – в жидком аммиаке.
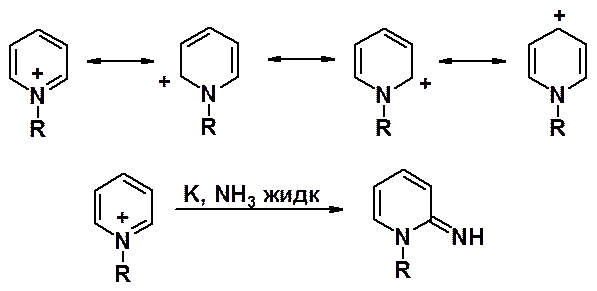
Из конденсированных бициклических моноазинов наиболее распространен хинолин.
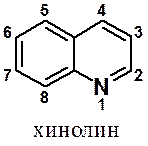
Основные и нуклеофильные свойства гетероциклического азота в хинолине близки к пиридиновому. Реакции с электрофильными реагентами идут в бензоядро, с нуклеофилами в положения 2 и 4 гетерокольца.
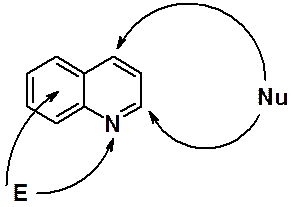
Синтез хинолина по Скраупу
Хинолин может быть получен в реакции анилина с глицерином, в нитробензоле в присутствии серной кислоты. Этот метод используют для получения замещенных в положениях 6 и 8 хинолинов, исходя из орто- или пара-замещенных анилинов. мета-Производные анилина в реакции Скраупа не используют из-за образования смеси 5- и 7-изомерных хинолинов.
Производные шестичленных азотсодержащих гетероароматических соединений играют важнейшую роль в процессах жизнедеятельности. Именно последовательность так называемых гетероциклических оснований (гетероциклов) в нуклеофиновых кислотах кодирует генетическую информацию.
В состав нуклеиновых кислот входят три производных пиримидина и два производных пирина.
Пиримидиновые основания:
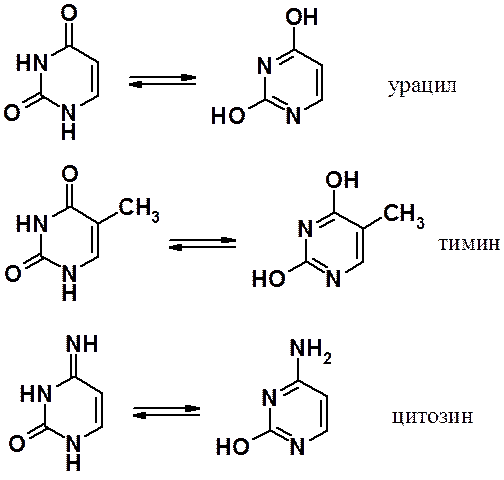
Пуриновые основания:

Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.