· Химические свойства. Реакции нуклеофильного замещения галогена у насыщенного атома углерода как метод получения спиртов, тиолов, простых эфиров, нитросоединений, аминов, нитрилов, сложных эфиров и др. Два механизма нуклеофильного замещения (SN1 и SN2). Бимолекулярные реакции (SN2): кинетика, стереохимия, обращение конфигурации. Мономолекулярные реакции (SN1): кинетика, стереохимия, рацемизация. Устойчивость и перегруппировки карбокатионов. Зависимость SN1 и SN2 реакций от природы радикала и уходящей группы субстрата, природы нуклеофильного агента и растворителя.
· Асимметрический атом углерода. Оптическая изомерия, оптическая активность. Энантиомеры. Рацематы. Хиральность органических молекул, конфигурация. Проекционные формулы Фишера. R,S-Номенклатура энантиомеров. Определение порядка старшинства заместителей у асимметрического атома углерода. Соединения с двумя асимметрическими атомами углерода. Диастереомеры. Понятие об асимметрическом синтезе. Представление о стереоизомерии соединений, не содержащих асимметрического углеродного атома (энантиомерия в ряду бифенила).
Стереоизомеры – вещества с одинаковым порядком связи атомов в молекуле, ног с различным их расположением в пространстве.
Строго говоря, уже цис-транс-изомерия в алкенах – стереоизомерия. Но для нее обычно используют другой термин – геометрическая изомерия. В последнее время стереоизомерами называют те, у которых есть асимметрический sp3-углеродный атом. Ранее, а иногда и сейчас, их называли оптическими изомерами.
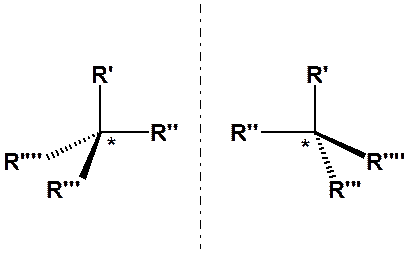
Показанные выше вещества, имеют одинаковый состав и порядок чередования атомов. Однако, попытки совместить одну формулу с другой оказываются неудачными (молекулу нельзя вынимать из плоскости листа). Не удается добиться совпадения положений всех заместителей. Это разные вещества, отличающие расположением атомов в пространстве. Такие свойства проявляют вещества с асимметрическим атомом углерода (асимметрический углерод показан звездочкой).
Атом углерода, связанный с четырьмя разными заместителями называется асимметрическим.
Стереоизомеры, молекулы, которых соотносятся друг с другом как зеркальное изображение, называются энантиомерами.
Стереоизомеры, молекулы, которых не соотносятся друг с другом как зеркальное изображение, называются диастереомерами.
Свойство предмета (молекулы) быть несовместимым со своим зеркальным изображением называется хиральностью. Соответствующие вещества называются хиральными (от греч. cheir – рука).
Нельзя путать конформеры и энантиомеры!
Энантиомеры – разные вещества, имеющие одинаковые все основные физические константы: температуры кипения и плавления, плотность, показатель преломления и др. Они отличаются только по отношению к поляризованному свету (свет в котором колебания происходят только в одной плоскости относительно линии распространения). Одни из энантиомеров вращает поляризованный свет по часовой стрелке на угол a, другой – на тот же угол, но против часовой стрелки (-a). Поэтому иногда энантиомеры называют оптическими антиподами (изомерами), а стереоизомерию – оптической изомерией.
Эквимолярную смесь разных энантиомеров называют рацематом. У рацематов угол вращения поляризованного света равен 0о.
Для обозначения конфигурации энентиомеров используют R,S-номенклатуру (от латин. rectus – правый, sinister – левый) Канна, Ингольда, Прелога (1951 г.). Номенклатура основана на правилах старшинства заместителей, которые аналогичны E,Z-изомерии алкенов.
При использовании R,S-номенклатуры молекулу располагают так, чтобы младший из заместителей находился за плоскостью листа и проводят обход оставшихся от старшего к младшему. Если этот обход совершается по часовой стрелке, то асимметрическому центру присваивают R-конфигурацию, если против – S-конфигурацию. Поскольку в молекуле может быть более одного асимметрического углерода, эту операцию выполняют для каждого. Общее число стереоизомеров связано с числом асимметрических атомов углерода простой формулой:
N = 2n
где: N – общее число стереоизомеров, n – число асимметрических атомов С.
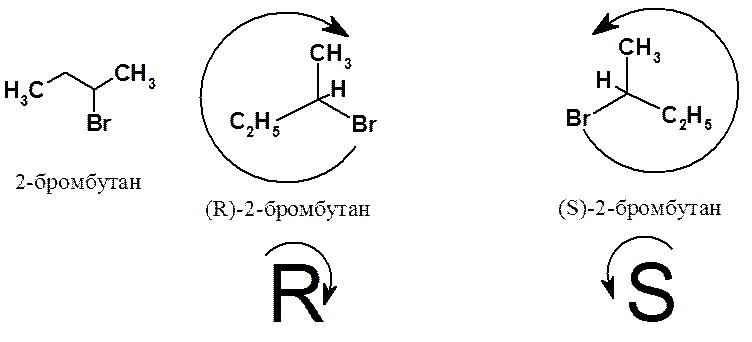
Следует отметить, что R,S-обозначения не имеют никакого отношения к направлению вращения поляризованного света. Это номенклатурное обозначение изображения молекулы на бумаге. Экспериментально определенное направление вращения обозначают (+)- и (-). Например: (+)-2-бромбутан. Рацематы обозначают (±).
Использование энантиомерно чистых веществ позволяет строго доказать механизмы нуклеофильного замещения в алифатическом ряду.
Предположим, что в реакцию был взят энантиомерно чистый (+)-2-бромбутан. Реакция по механизму SN2 начинается с атаки нуклеофила с тыла молекулы и проходит через переходное состояние (показано в квадратных скобках). В переходном состоянии углеводородный фрагмент лежит в одной плоскости. Нуклеофил подходит к ней, а бром отходит от нее перпендикулярно. В результате замещения происходит обращение конфигурации и (+)-2-бромбутан превращается в (-)-бутанол-2.
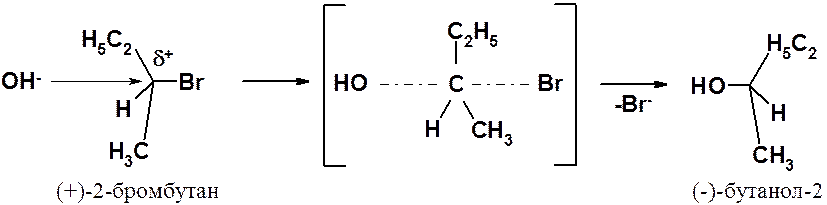
Экспериментальные исследования полностью подтвердили этот механизм.
Если в реакцию SN1 ввести энантиомерно чистый (+)-3-бром-3-метилгексан, то отщепление аниона брома приведет к образованию карбокатиона. Атом углерода, несущий положительный заряд, находится в sp2-гибридизованном состоянии. Все s-связи лежат в одной плоскости, а свободная негибридизованная орбиталь перпендикулярна этой плоскости.
Атака нуклеофила равновероятна с обеих сторон плоскости. В результате образуется смесь энантиомеров в равном соотношении – рацемат. В реальном эксперименте именно так и происходит.
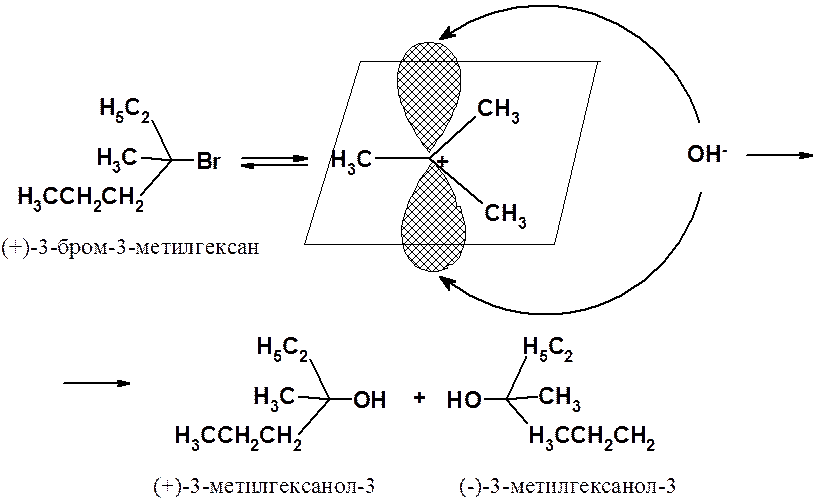
Таким образом, бимолекулярное нуклеофильное замещение всегда протекает с полным обращением конфигурации, а мономолекулярное – с рацемизацией.
Реакционная способность галогенопроизводных в SN2 реакциях определяется пространственными факторами. Чем меньше размер заместителей около реакционного центра, тем легче нуклеофилу атаковать с тыла. Реакционная способность уменьшается в ряду:
СН3 > первичный > вторичный > третичный.
В реакциях SN1 реакционная способность зависит от устойчивости карбониевого катиона. В приведенном ниже ряду реакционная способность уменьшается:
аллильный, бензильный > третичный > вторичный > первичный > метильный.
Аллильный и бензильный карбониевые катионы обладают повышенной стабильностью вследствие сопряжения.
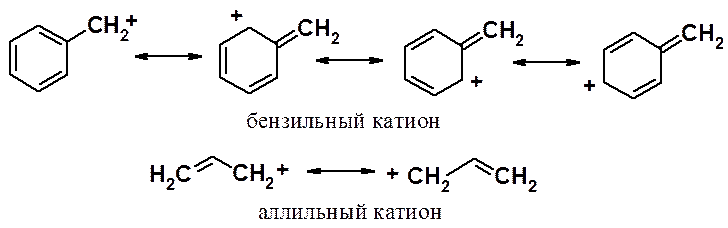
Реакционоспособные (сильные) нуклофилы (-NH2, C2H5O-) предпочтительно реагируют по бимолекулярному механизму, слабые (NH3, C2H5OH) – по мономолекулярному.
Полярные растворители лучше сольватируют ионы, чем неполярные. Поэтому использование неполярных растворителей благоприятствует реакции SN1, полярных - SN2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.