· Галогенарены. Номенклатура, строение и реакционная способность атома галогена, связанного с ароматическим ядром. Физические и спектральные свойства. Получение галогенаренов прямым галогенированием аренов, с использованием солей диазония. Химические свойства. Реакции нуклеофильного замещения галогена в ароматическом ряду. Влияние заместителей на подвижность галогена в ароматическом ядре. Галогены как ориентанты в реакциях электрофильного ароматического замещения. Реакции с металлами и их использование в органическом синтезе.
К этой группе галогенопроизводных принадлежат вещества, в которых атом галогена связан непосредственно с углеродом ароматического цикла.
Их относят к галогенопроизводным с пониженной реакционной способностью. Рассмотрим строение галогенноаренов и причины их низкой реакционной способности.
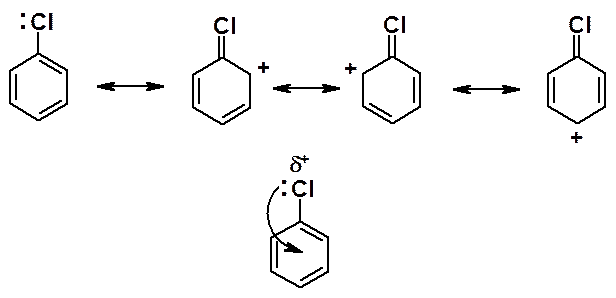
Галогены обладают положительным мезомерным эффектом (+М), находятся в сопряжении с ароматическим кольцом и электронная плотность частично втянута в цикл. Связь углерод-галоген частично двойная, значительно прочнее связи углерод (sp3)-галоген.
В реакциях ароматического электрофильного замещения галогены являются дезактивирующими заместителями и орто-пара-ориентантами (см. разд. «Бензол»).
Галогеноарены (с меньшей охотой, чем галогеноалканы) вступают в реакции с металлами. Это свойства используют для получения гомологов бензола по реакции Вюрца-Фиттига.
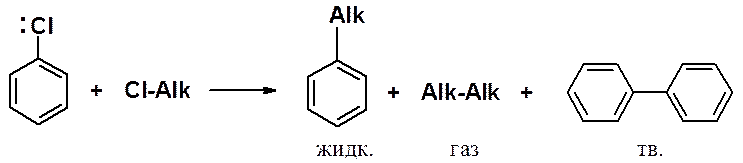
Разделение образующейся в реакции смеси не представляет особой сложность, вследствие заметных различий физических свойств.
Реакции ароматических галогенопроизводных с магнием используется для получения реактивов Гриньяра, применение которых будет описано в следующих разделах.
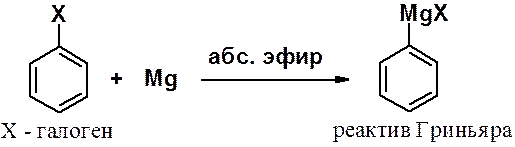
Поскольку галогеноарены – соединения с низкой реакционной способностью – реакции нуклеофильного замещения, характерные для насыщенных галогенопроизводных, в это ряду не имеют такого большого значения. Очень часто эти реакции идут только в очень жестких условиях. Однако, в некоторых случаях реакции ароматического нуклеофильного замещения протекают очень легко.
Замещение хлора на гидрокси-группу в хлорбензоле возможно только при 300о и давлении 300 атм.
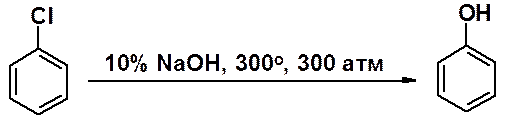
пара-Нитрозамещенный хлорбензол вступает в аналогичную реакцию уже при 160о.
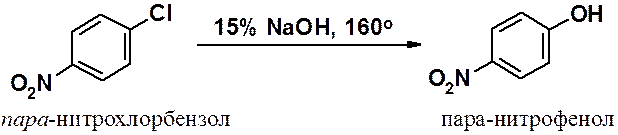
Еще легче протекает замещение галогена в ди- и тринитрохлорбензолах.
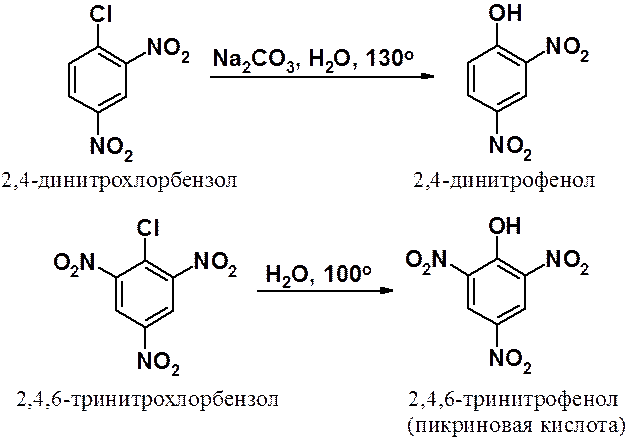
Аналогичная картина и в реакциях арилгалогенидов с другими нуклеофилами. Например, аминирование тринитрохлорбензола протекает намного легче, чем аналогичная реакция хлорбензола.
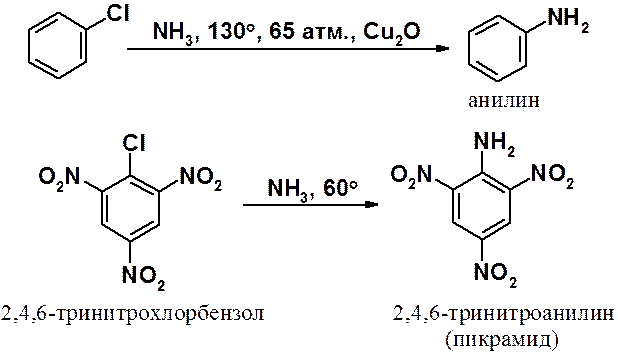
Кроме того, известны случаи, когда легко протекают реакции в незамещенных арилгалогенидах под действием очень сильных оснований (superbase) в аротонных растворителях.

Эти реакции проходят по разным механизмам.
Механизм этой реакции состоит из двух стадий:
1. атака нуклеофила по углеродному атому, связанному с галогеном, с образованием анионного сигма-комплекса;
2. реароматизация – отщепление аниона галогена от sp3-углерода в анионном s-комплексе.
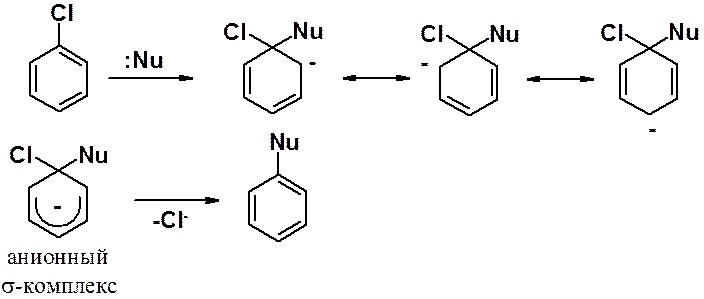
Строение анионного s-комплекса подобно строению s-комплекса, образующегося в ходе реакции ароматического электрофильного замещения. Один углерод находится в тетраэдрической гибридизации и не участвует в делокализации p-электронов. На пяти sp2-углеродах делокализованы 6 p-электронов.
Анионные s-комплексы часто называют комплексами Мейзенгеймера, который в 1902 г первым среди химиков-органиков выделил промежуточный продукт реакции.
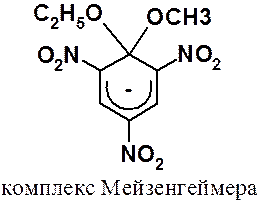
Энергетическая диаграмма реакции показана на рис. 25.1.


Рис. 25.1. Энергетическая диаграмма реакции присоединения-отщепления
Первая стадия (образование s-комплекса) является лимитирующей. Это доказано влиянием природы галогена на скорость замещения. Если образование или разрыв связи углерод-галоген происходит в лимитирующей стадии, скорость реакций будет зависеть от природы галогена. В эксперименте выраженной зависимости скорости реакции от природы галогена не обнаружено. Следовательно, разрыв связи углерод-галоген происходит в быстрой стадии реакции.
Акцепторые группы обладают дезактивирующими свойствами в реакциях ароматического электрофильного замещения. Поскольку в реакциях присоединения-отщепления ароматический цикл атакует частица с противоположным знаком, очевидно, что в реакциях с нуклеофилами акцепторы – активирующие заместители, доноры – дезактивирующие.
Наличие в положениях 2 или/и 4 или/и 6 электроноакцепторных групп увеличивает реакционную способность галогена в реакциях присоединения-отщепления. Причем, чем больше акцепторов в указанных положениях, тем легче замещается галоген.
Если в положениях 2 или/и 4 или/и 6 расположены электронодонорные группы, реакционная способность галогена в реакциях присоединения-отщепления снижается. Причем, чем больше доноров в указанных положениях, тем труднее происходит замещение галогена.
Если акцепторные или донорные группы расположены в положениях 3 или/и 5 их активирующее или дезактивирующее действие выражено очень слабо.
Для объяснения изменений реакционной способности ароматических галогенопроизводных надо рассмотреть стабильность промежуточно образующегося в реакции анионного s-комплекса, который ближе всего по энергии к вышей энергетической точке реакции – активированному комплексу первой стадии реакции. Рассмотрим на примере нитрогруппы.
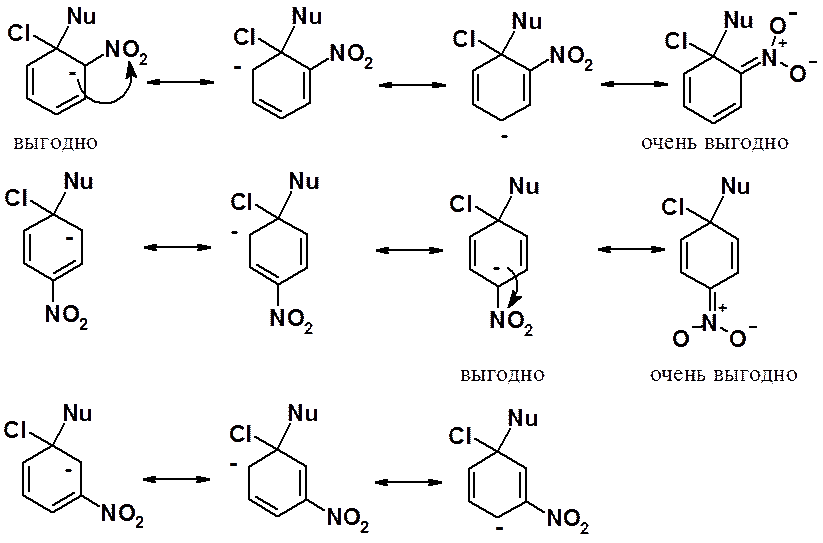
Если акцепторная группировка расположена в орто- или пара-положениях, можно отметить две выгодные граничные структуры, наличие которых позволяет сделать вывод о стабилизационном влиянии акцептора на анионный s-комплекса. Если нитрогруппа или любой акцептор находятся в мета-положении к галогену, такого выраженного стабилизирующего действия они не оказывают. Незначительная активация вызывается только общим - I-эффектом.
Влияние донорных группировок.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.