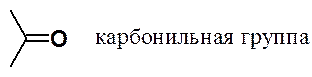
В зависимости от количества органических радикалов, связанных с карбонильной группой этот класс веществ делят на альдегиды и кетоны:
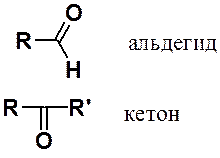
Названия некоторых альдегидов и кетонов
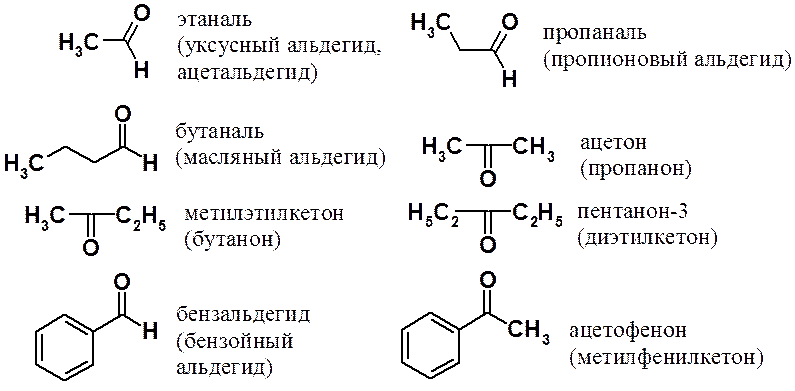
В предыдущих разделах курса рассмотрены следующие методы получения карбонильных соединений:
· окислением спиртов;
· озонолизом алкенов;
· гидратацией алкинов (получаются кетоны и единственный альдегид – уксусный);
· ацилированием бензолов по Фриделю-Крафтсу (ароматические и смешанные кетоны);
· формилированием фенолов (ароматические альдегиды фенольного ряда).
Общий метод получения любых карбонильных соединений – гидролиз геминальных дигалогенопроизводных с нормальной и повышенной реакционной способностью.
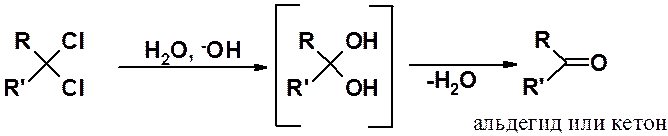
Образующийся в результате гидролиза геминальный диол неустойчив и быстро отщепляет воду с образованием карбонильного соединения.
Другой универсальный метод получения альдегидов и кетонов – пиролиз (сухая перегонка) кальциевых солей карбоновых кислот.
В результате нагрева (без растворителя) кальциевой соли карбоновой кислоты происходит декарбоксилирование с образованием кетона.
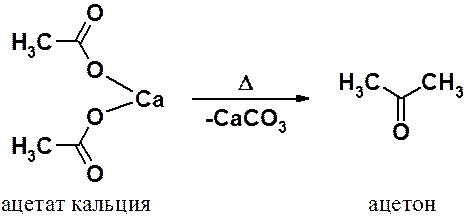
Декарбоксилирование смешанной соли приводит к несимметричным кетонам.
Если в смешанной соли один из фрагментов – формиат (остаток муравьиной кислоты), в результате декарбоксилирования образуется альдегид.
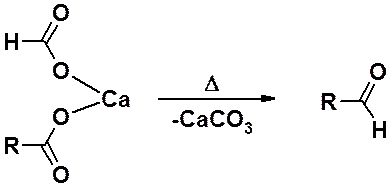
Интересно, что не обязательно получать смешанную соль в индивидуальном виде. Если две кальциевые соли разных карбоновых кислот тщательно измельчить и перемешать, а затем смесь подвергнуть пиролизу, результат будет тем же самым, как если бы в реакции была использована смешанная соль.
Кетоны получают мягким и селективным восстановлением по Оппенауэру трет-бутилатом или изопропилатом алюминия в ацетоне.
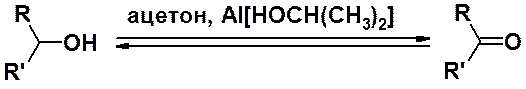
Окислительное расщепление двойной связи в тетразамещенных алкенах приводит к кетонам. В этой реакции желательно использовать симметричные алкены.
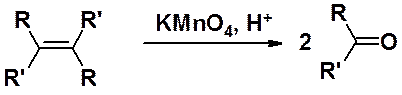
Реакция магниорганических соединений с солями кадмия, с последующим взаимодействием кадмийорганического соединения с хлорангидридом – способ получения кетонов.
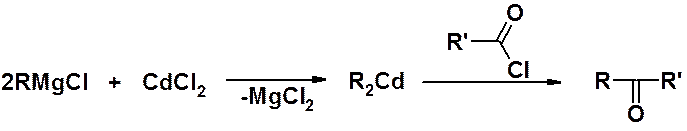
Кетоны могут быть получены и реакцией нитрилов с реактивами Гриньяра. Образующуюся в результате реакции при низкой температуре соль кетимина гидролизуют, получая целевой продукт.
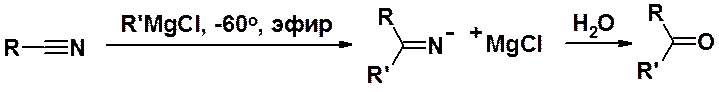
Альдегиды могут быть получены восстановлением нитрилов (цианидов) и хлорангидридов карбоновых кислот.
Восстановление нитрилов проводят медленным прибавлением к раствору цианида в ТГФ раствора литийаллюминийгидрида в ТГФ при низкой температуре с последующим разложением реакционной массы разбавленной кислотой. В этой реакции очень важна последовательность смешения реагентов. Другая последовательность не приводит к желаемому результату.
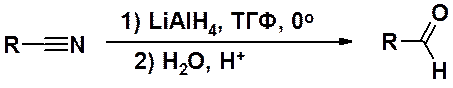
Восстановление хлорангидридов осуществляют литийаллюминийгидридом в трет-бутилате калия при низкой температуре, чтобы не происходило дальнейшее восстановление альдегида до спирта.
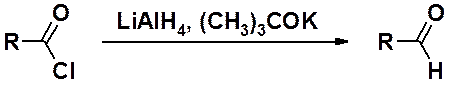
Распространенный метод получения ароматических альдегидов – окисление метиларенов. Здесь следует очень тщательно подбирать окислитель и условия проведения реакции. Проблема в том, что альдегиды окисляются намного легче исходных метиларенов, поэтому необходимо найти условия, в которых этот процесс не осуществляется.
Хорошие результаты могут быть получены при окислении метилбензолов оксидом хрома (VI) в ацетальдегиде.
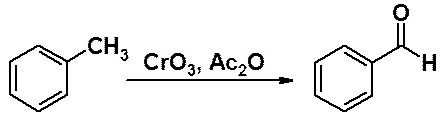
Важный промышленный метод синтеза альдегидов – оксосинтез (гидроформилирование алкенов). Реакция заключается в присоединении угарного газа (оксида углерода II) и водорода к алкену при температурах от 100 до 200 оС, давлении от 100 до 300 атм., в присутствии катализатора, например, смеси кобальта, оксида технеция (IV) и оксида магния на кизельгуре или октакарбонилкобальта. В результате образуется смесь изомерных альдегидов с некоторым преобладанием неразветвленного изомера.
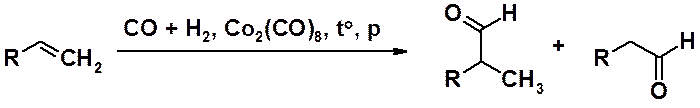
Химические свойства карбонильных соединений определяются свойствами карбонильной группы.
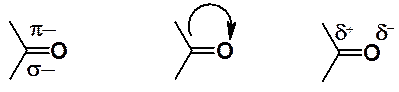
Двойная связь кислород-углерод похожа на углерод-углеродную двойную связь. Обе представляют собой комбинации s- и p-связей. Как уже было показано, для такой связи характерны реакции присоединения. Высокая электроотрицательность атома кислорода приводит к сдвигу в его сторону электронной плотности, а у атома углерода электронная плотность понижена. Следует ожидать, что позитивированный атом углерода в ходе реакций присоединения способен подвергаться атаке частицами, способными предоставить пару электронов для образования ковалентной связи с карбонильным углеродом.
Таким образом, строение карбонильной группы указывает на способность альдегидов и кетонов участвовать в реакциях нуклеофильного присоединения (AN).
Некоторые AN реакции рассматривались в предыдущих разделах курса. Так, реакции карбонильных соединений с реактивами Гриньяра, приводящая к спиртам (см. раздел «Спирты») и взаимодействие с ацетиленами (реакция Фаворского, см. «Алкины»), – типичные примеры нуклеофильного присоединения к карбонильной группе
Какова относительная реакционная способность альдегидов и кетонов в реакциях AN?
Из общих соображений можно выдвинуть следующее предположение:
· чем ниже электронная плотность на карбонильном углероде, тем легче нуклеофилу атаковать этот электрофильный центр.

Алкильные группы, как и атом водорода, обладают +I (донорным) эффектом, т.е. увеличивают электронную плотность на карбонильном углероде, уменьшая его электрофильность. Известно, что донорные свойства алкильных групп выражены в гораздо большей степени, чем аналогичные свойства атома водорода. Поэтому, альдегиды обладают большей реакционной способностью в реакциях AN.
Поскольку донорные свойства всех алкильных групп примерно одинаковы, следует ожидать, что все альдегиды и все кетоны будут иметь примерно одинаковую реакционную способность внутри ряда. Однако, реакции нуклеофильного присоединения к ацетону идут во много раз быстрее, чем аналогичные реакции с ди-трет-бутилкетоном. Для оценки реакционной способности следует рассматривать также стерические (пространственные) факторы. Чем больше размер, связанных с карбонильной группой, заместителей, тем труднее нуклеофилу подойти на расстояние стандартной длины связи. Поскольку размер атома водорода много меньше размера любой алкильной группы, стерический фактор, также как и индуктивный, указывает на более высокую активность альдегидов по сравнению с кетонами в реакциях AN. Самый активный среди карбонильных соединений – формальдегид.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.