Альдегиды и кетоны
· Химические свойства альдегидов и кетонов. Реакции карбонильной группы с C-, N-, O-, S-нуклеофилами: реактивами Гриньяра, синильной кислотой, ацетиленом, аминами, гидроксиламином, гидразином и его производными, водой, спиртами, тиолами, бисульфитом натрия. Механизм реакции нуклеофильного присоединения, влияние энергетических и структурных факторов на характер протекания процесса, роль кислотного и основного катализа. Реакции альдегидов и кетонов с реактивами Гриньяра, получение спиртов.
· Реакции присоединения-отщепления: взаимодействие с аминами (образование азометинов), гидроксиламином (образование оксимов), гидразинами и его производными (образование гидразонов), активными метиленовыми соединениями (конденсация Кневенагеля), полимеризация карбонильных соединений.
Альдегиды и, в меньшей степени кетоны, в воде существуют в виде гем-диола. Например, формальдегид в водном растворе полностью находится в виде ковалентного гидрата.
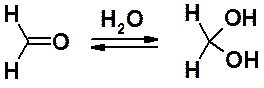
Гем-диольная форма существует только в воде. Попытки выделить ее в индивидуальном виде приводят к полному сдвигу равновесии влево. Наличие в a-положении к карбонильной группе акцепторных заместителей сдвигает равновесии вправо и придает устойчивость диольной форме. Например, трихлорацетальдегид, присоединяя воду, образует устойчивую форму – хлоральгидрат. Отщепление воды от хлоральгидрата возможно только действием концентрированной H2SO4.
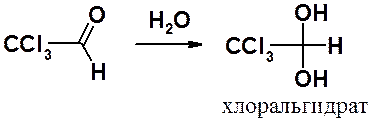
В присутствии катализатора спирты присоединяются к альдегидам с образованием полуацеталей и ацеталей («полных ацеталей»).
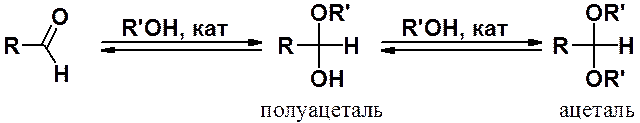
Реакции с кетонами идут намного труднее.
Образование полуацеталей может катализироваться кислотами и основаниями.
Кислотный катализ:
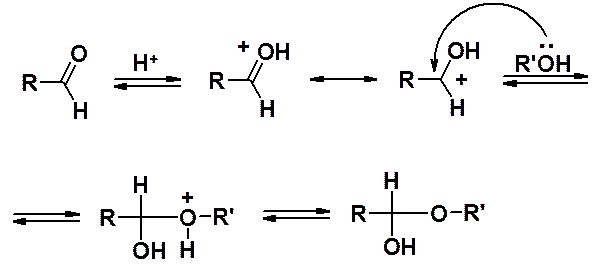
Основной катализ:
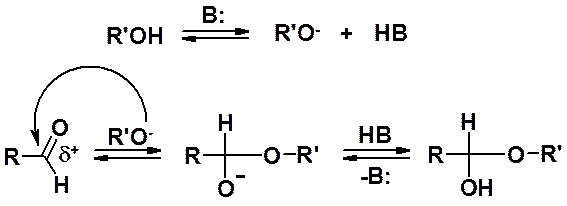
В кислой среде катализатор активирует карбонильное соединение, превращая его в катион, и увеличивает склонность к взаимодействию с нуклеофилом (спиртом). В присутствие основания происходит обратимое образование алкоксид-аниона, обладающего более выраженными нуклеофильными свойствами, чем спирт.
Образование ацеталя катализируется только кислотами, но не основаниями. В молекуле полуацеталя отсутствует выраженный электрофилный центр, поэтому активация нуклеофила не приводит к желаемому результату. Кислотный катализатор, протонируя молекулу полуацеталя, генерирует электрофильный центр, способный реагировать со спиртом (нуклеофилом).
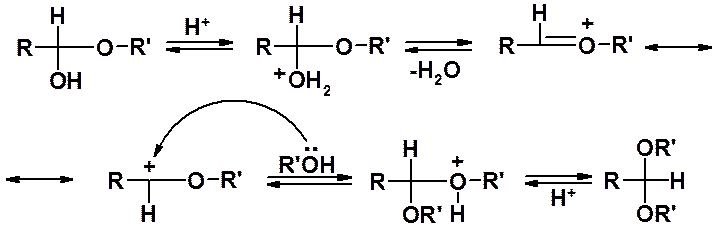
Как видно из механизма – реакция обратима на всех стадиях. Обратная реакция – гидролиз, причем гидролиз ацеталя может быть проведен только в кислой среде, полуацеталя – в кислой и щелочной.
Обратимость получения ацеталей часто используют для защиты карбонильной группы. Например, восстановление нитро- или сложноэфирной группы в альдегиде или кетоне может привести и к восстановлению карбонильной группы. Превращение карбонильной группы в ацеталь, последующее восстановление и гидролиз ацеталя, позволяет провести восстановление и сохранить карбонильную группу.
В кислой среде, но не в основной, тиолы присоединяются к карбонильным соединениям с образованием дитиоацеталей.
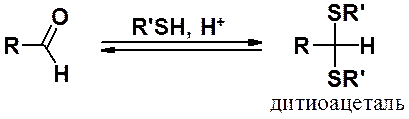
Гидролиз дитиоацеталей проходит в значительно более жестких условиях, чем в случае ацеталей.
Синильная (циановодородная) кислот присоединяется к альдегидам и кетонам с образованием циангидринов (гидроксинитрилов), что позволяет увеличить углеродную цепь молекулы на один атом. Поскольку сама синильная кислота малодиссоциирована, реакцию проводят в присутствии каталитических количеств ее соли или основания, генерирующих в реакционной массе нуклеофильные цианид-анионы. Примечательно, что эта реакция – одно из первых превращений, механизм которых был достоверно установлен (Лануорт, 1902 г.)
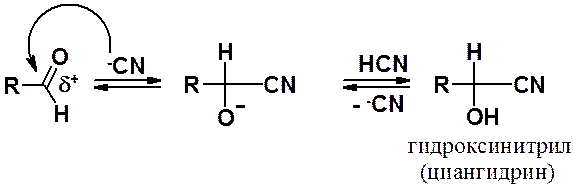
Циангидрины ценные промежуточные соединения в синтезе гидроксилсодержащих карбоновых кислот, амидов и др. Кроме того, дегидратацией гидроксинитрилов можно получать непредельные соединения, некоторые из которых являются ценными мономерами, например, метилметакрилат.
Альдегиды, метил- и алициклические кетоны реагируют с бисульфитом (гидросульфитом) натрия с образованием a-гидросульфонатных (бисульфитных) производных. Растворимость бисульфитных производных в воде и обратимость бисульфитной реакции часто используется для очистки и выделения соответствующих карбонильных производных.
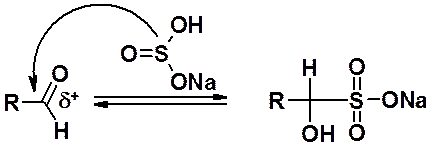
Нуклеофильное присоединение к карбонильным соединением веществ, содержащих первичную амино-группу, сопровождается отщеплением воды и получило название «реакций отщепления-присоединения». Классифицируются такие реакции как AN.
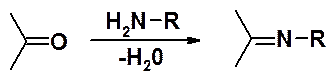
Реакция протекает в слабокислой среде, что позволяет активировать карбонильное соединение. При высоких концентрациях кислоты проявляется антикаталитический эффект за счет образования аммонийных производных (+NH3-R), которые не проявляют нуклеофильные свойства).
Общий механизм реакций присоединения-отщепления:
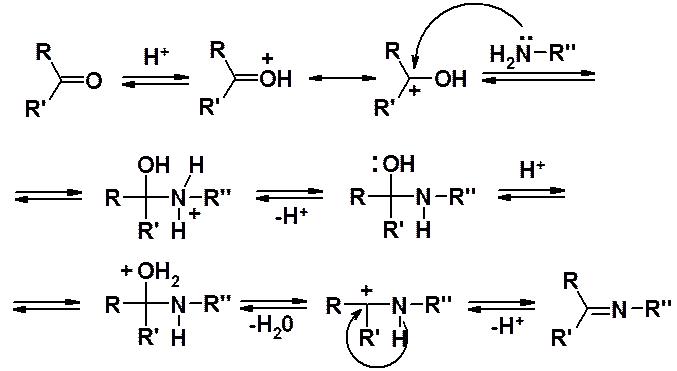
Взаимодействие карбонильных соединений с первичными аминами приводит к иминам (азометинам, основаниям Шиффа).
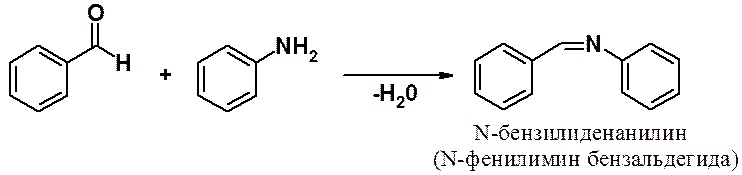
Имины алифатических карбонильных соединений и алифатических аминов неустойчивы и быстро разлагаются или полимеризуются. Например, в реакции формальдегида с аммиаком не удается получить имин формальдегида (H2C=NH).
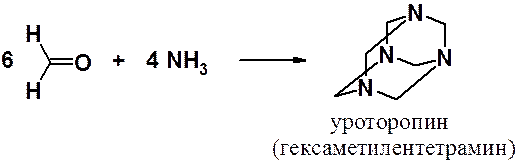
Уротропин – первое органическое соединение, строение которого установлено с помощью метода рентгеноструктурного анализа, применяется в качестве анитисептика и как сухое горючее.
Кроме первичных аминов в реакциях присоединения-отщепления могут участвовать оксимы, гидразины и семикарбазиды.
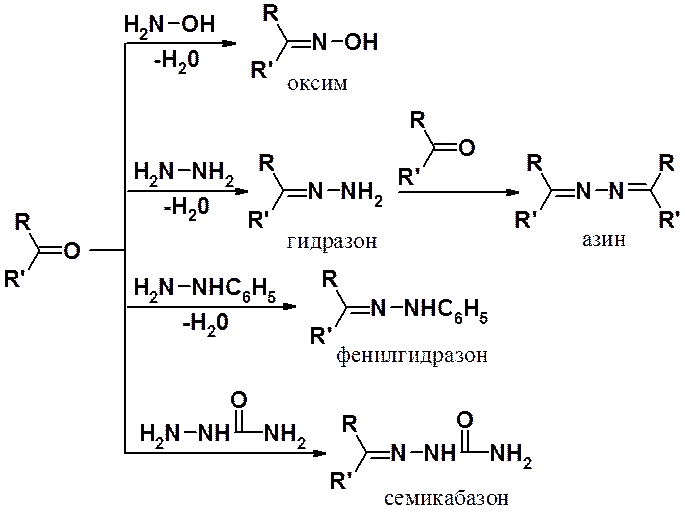
С-Нуклеофилы, генерируемые в присутствии оснований из сильных СН-кислот, достаточно легко вступают в конденсацию с карбонильными соединениями с образованием непредельных соединений.
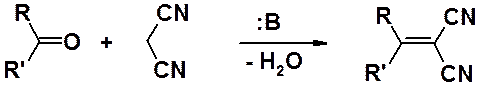
Например, динитрил малоновой кислоты легко реагирует с карбонильными соединениями, образуя дицианоалкен.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.