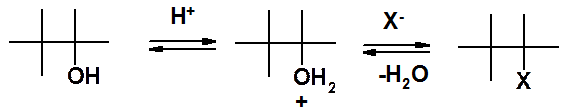
Первая стадия (атака протона) еще не нуклеофильное замещение. Это активация спирта. Вторая стадия – собственно нуклеофильное замещение.
Побочные реакции при замещении ОН-группы на галоген не наблюдаются при проведении замещения галогенидами фосфора.
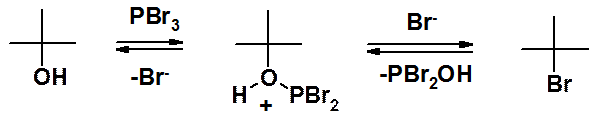
И в этой реакции нуклеофильное замещение только вторая стадия
Механизм конкретной реакции зависит от строения углеводородного радикала. Первичные спирты всегда вступают в реакцию SN2, третичные - SN1. Вторичные, в общем случае, могут реагировать по обоим механизмам. Бимолекулярные реакции идут с обращением конфигурации, мономолекулярные – с рацемизацией.
Очень хорошие результаты получены при использовании в качестве хлорирующего агента хористого тионила (SOCl2).
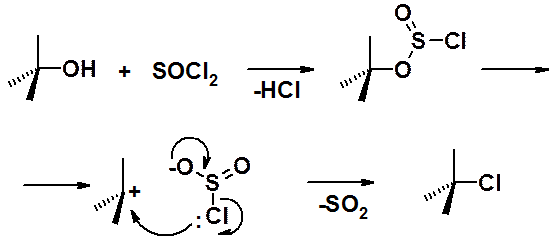
Важная особенность: реакция протекает с сохранением конфигурации. Т.е. если взять в реакцию энантиомерно чистый спирт, то в результате мы получим хлорпроизводное с той же самой абсолютной конфигурацией. Такие реакции носят название SNi (от internal – вниутримолекулярный).
Спирты – исходные вещества для получения сложных эфиров, важных производных карбоновых кислот. Один из основных методов получения сложных эфиров – реакция этерификации.
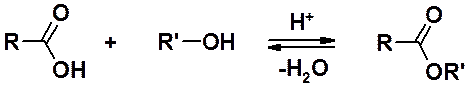
Особенности и механизм реакции этерификации, а также другие методы получения сложных эфиров будут рассмотрены в разделе «Карбоновые кислоты».
В присутствии серной кислоты спирты способны вступать в межмолекулярную дегидратацию с образованием простых эфиров.
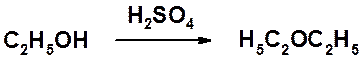
Эта реакция ограничена получением только симметричных простых эфиров. Получение несимметричных производных проводится по реакции Вильямсона – взаимодействие галогенопроизводного с нормальной или повышенной реакционной способностью и алкоксид-аниона.
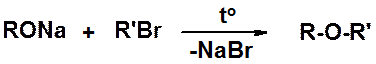
Внутренняя сущность реакции – замещение атома галогена алкоксид-анионом (нуклеофилом).
Спирты легко могут быть окислены перманганатом калия, бихроматом калия в серной кислоте, оксидом хрома VI в разбавленной H2SO4 или пиридине и др. окислителями.
Окисление первичных спиртов приводит к альдегидам, вторичных - к кетонам.
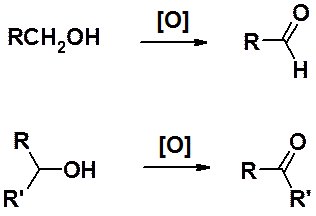
Среди двухатомных спиртов наибольшее значение имеет этиленгликоль (этандиол-1,2), используемый в смесь с водой в качестве антифриза в двигателях внутреннего сгорания.
Промышленный метод получения этиленгликоля – гидролиз оксирана.
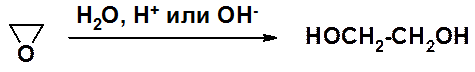
Второй промышленно важный двухатомный спирт – 1,4-бутандиол – промежуточный продукт в одном из промышленных методов синтеза бутадиена-1,3. Бутандиол-1,4 синтезируют гидрированием тройной связи ацетиленового спирта, полученного по реакции Репе из ацетилена и формальегида.
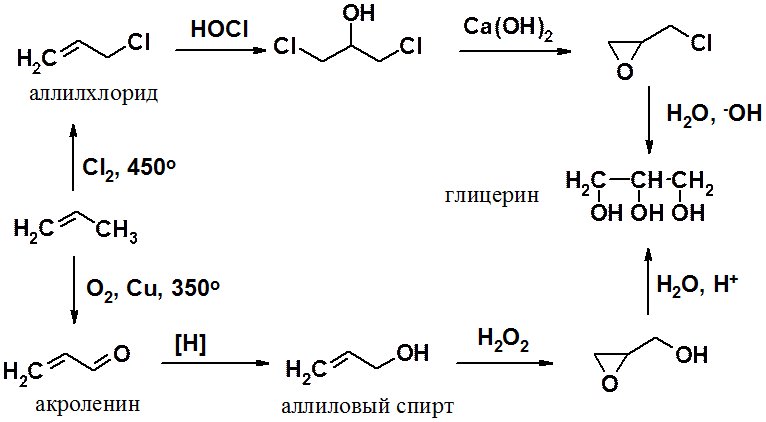
Среди трехатомных спиртов наибольшее значение имеет глицерин, впервые полученный еще в 1779 г. К. Шееле гидролизом жиров.
В настоящее время этот широко используемый продукт получают в промышленности из пропилена одним из двух способов:
Гидроксилпроизводные со связью С(sp2)-OH.
· Фенолы. Изомерия, номенклатура. Физические свойства и спектральные характеристики. Получение фенола: кумольный метод, гидролиз ароматических галогенопроизводных, щелочное плавление сульфокислот, гидролиз солей диазония.
· Химические свойства (в сравнении со спиртами). Кислотные свойства. Влияние заместителей в цикле на кислотность фенолов. Образование фенолятов, простых и сложных эфиров. Особенности реакций электрофильного замещения водорода ядра у фенолов. Конденсация фенолов с альдегидами. Фенолформальдегидные смолы. Гидрирование и окисление фенолов. Фенол, крезолы, пикриновая кислота, a- и b-нафтолы (получение и применение). Техника безопасности при работе с фенолами.
Фенолы – соединения, в которых ОН-группа связана с бензольным кольцом.

Гидролиз ароматических галогенопроизводных см. выше.
Сплавление сульфокислот с твердой щелочью – универсальный метод получения фенола и его производных.
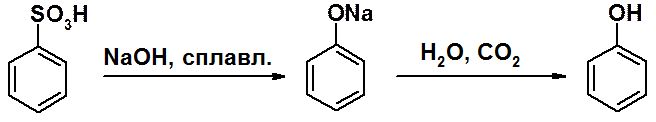
Один из промышленных методов синтеза бензола – кумольный метод – процесс, в котором образуются два промышленно важных и легко разделяемых соединения (фенол и ацетон).
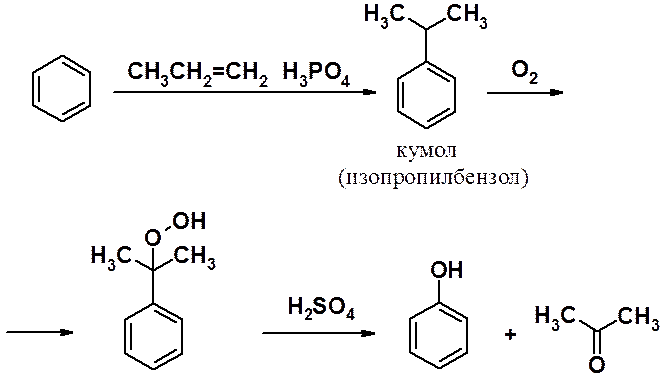
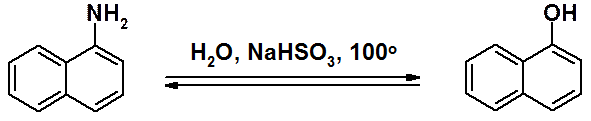
Первичные ароматические амины превращают в фенолы через соли диазония.

a- и b-Нафтолы получают щелочным плавлением соответствующих нафталинсульфокислот. В ряду нафталина (но не бензола) возможно прямое замещение NH2-группы на гидроксильную гидролизом (реакция Бухерера).
Старое название фенола – карболовая кислота, указывает на выраженные кислотные свойства. Фенолы более сильные кислоты, чем спирты (pKa фен = 10, pKa МеОН = 16). Причина таких свойств – повышенная, по сравнению с алкоксид-, стабильность фенолят аниона за счет сопряжения.
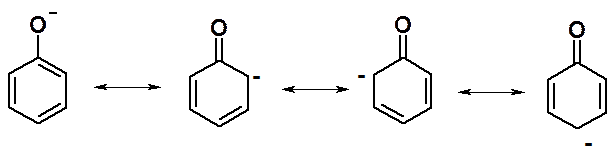
Образование фенолятов возможно в реакциях с водными щелочами. Обратная реакция протекает под действием любой минеральной кислоты.
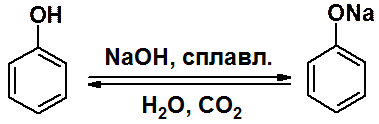
Заместители в бензольном цикле заметно влияют на кислотность. Наличие в положениях 2 или/и 4 или/и 6 электроноакцепторных групп увеличивает кислотность. Причем, чем больше акцепторов в указанных положения, тем легче проходит замещение галогена.
Если в положениях 2 или/и 4 или/и 6 расположены электронодонорные группы, кислотность уменьшается. Причем, чем больше доноров в указанных положения, тем труднее происходит замещение галогена.
Если акцепторные или донорные группы расположены в положениях 3 или/и 5 их активирующее или дезактивирующее действие выражено очень слабо.
Для объяснения изменений кислотности фенолов надо рассмотривать стабильность образующегося аниона. Логика анализа феноксид-аниона по устойчивости граничных структур аналогична рассмотрению стабильности s-комплекса, в реакциях нуклеофильного замещения галогена в ароматическом ряду (см. лекцию 25).
Простые эфиры фенолов получают реакцией фенолят-аниона с алкилгалогенидом.
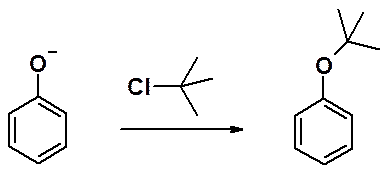
Алкилфениловые эфиры термодинамически очень устойчивы. Только в одном из простых эфиров фенолов – метилфениловом эфире – удается провести расщепление эфирной связи с образованием исходных соединений. Эта реакция часто используется для защиты гидроксигруппы.
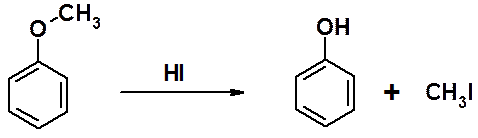
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.