При синтезе реактивов Гриньяра в молекуле не должны находиться группы: -COOH, -OH, -NH2, -SO3H, -COOR, -C(O)-, NO2, -CN. Несмотря на такие ограничесния, число возможных вариантов использования реактивов Гриньяра столь велико, что открытие французского химика является одним из самых ценных в синтетической органической химии. При правильном выборе реагентов и аккуратном проведении синтеза реакции Гриньяра всегда дают нужный результат.
Спирты – органические соединения, в молекулах которых есть одна (одноатомные) или несколько (многоатомные) ОН-групп, связанных с sp3-углеродным атомом.
Как и другие классы органических веществ, спирты классифицируют по углеродному атому, с которым связана ОН-группа, на первичные, вторичные и третичные.
В номенклатуре спиртов используют тривиальные названия, спиртовую и номенклатуру IUPAC.
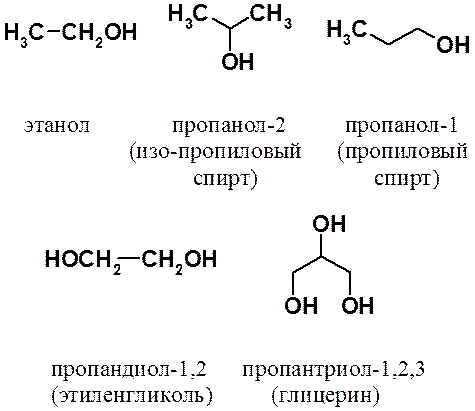
Методы синтеза
Ранее обсуждалось получение спиртов гидратацией алкенов и гидролизом галогеноалканов.
Восстановление альдегидов приводит к первичным, а кетонов – к вторичным спиртам.
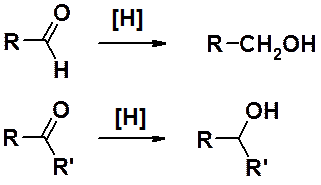
Существует много методов восстановления карбонильных соединений. Оно может быть проведено: водородом на гетерогенном катализаторе (Pt, Pd, Ni), амальгамой цинка в присутствии соляной кислоты (по Клеменсену), гидразином (NH2-NH2) в присутствии сильных оснований (по Кижнеру-Вольфу), литийаллюминийгидридом (LiAlH4) в абсолютном апротонном растворителе. Следует отметить восстановление борогидридом натрия (NaBH4), который не восстанавливает двойные связи, что позволяет получать непредельные спирты.
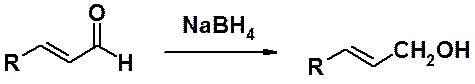
Гидратация алкенов не позволяет получать первичные спирты. Прекрасным методом получения спиртов против «правила Марковникова» является реакция гидроборирования-окисления. На первой стадии синтеза алкен, реагируя с гидридом бора (кислотой Льюиса), образует алкилборан, окисление которого перекисью водорода в щелочной среде приводит к спирту.
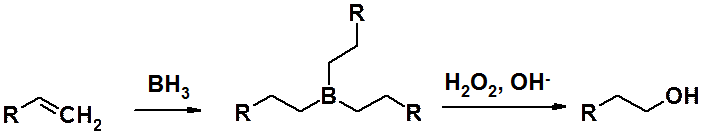
ОН-Группа в продукте всегда связана с наиболее гидрогенизированным атомом исходного алкена.
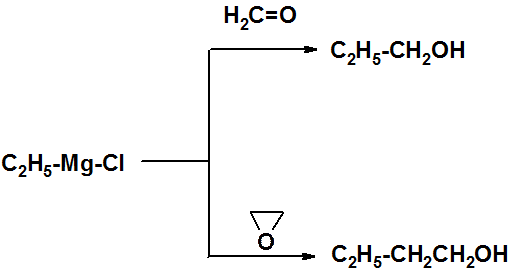
Самые разнообразные по строению спирты получают в реакциях с реактивами Гриньяра.
Для получения первичных спиртов используют формальдегид или эпоксиэтилен.
Реакции реактивов Гриньяра с альдегидами приводят к вторичным спиртам, а с кетонами – к третичным.
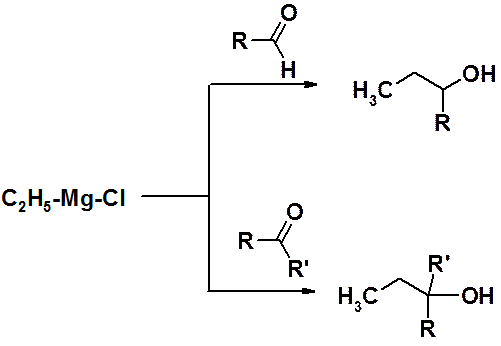
Реакции Гриньяра особенно важны в случаях, когда строение углеродного скелета продукта реакции и исходных веществ значительно отличаются. Углерод-углеродная связь всегда образуется между атомов углерода карбонильной группы и углеродом, связанным с металлом (в прошлом – с галогеном).
Для получения, имеющих большое промышленное значение, низших спиртов (метилового и этилового) разработаны специальные методы.
Метанол получают каталитическим гидрирование угарного газа.
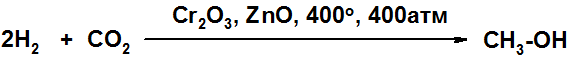
Технический этанол синтезируют гидратацией этилена, большие количества которого получают крекингом. Технический спирт всегда содержит значительное количество примеси – пропнола-2, поскольку не проводят полное отделение этилена от пропилена.
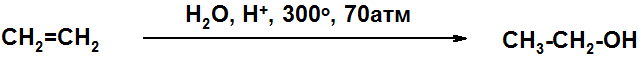
Этанол для медицинских и бытовых целей получают ферментативным гидролизом растительного сырья, содержащего большое количество полисахаридов (в первую очередь крахмала).
Гидроксилпроизводные со связью С(sp3)-OH.
· Химические свойства. Кислотные свойства, константа кислотности. Образование алкоголятов, их свойства. Основные свойства спиртов, соли оксония. Реакция этерификации. Дегидратация, образование алкенов и простых эфиров. Нуклеофильное замещение гидроксила на галоген. Окисление спиртов. Отдельные представители: метанол, этанол, изопропанол (получение, использование).
· Многоатомные спирты. Двухатомные спирты: этиленгликоль, бутандиол-1,4. Трехатомный спирт глицерин. Методы получения, особенности химических свойств и применение. Техника безопасности при работе с метиловым и этиловым спиртами, этиленгликолем.
Свойства спиртов определяются характером гидроксильной группы:

· электроноакцепторный атом кислорода сдвигает к себе электронную плотность связи О-Н, что приводит к появлению кислых свойств;
· аналогичный сдвиг к кислороду электронной плотности связи С-О приводит к появлению на спиртовом углероде частичного положительного заряда, что создает возможность атаки этого центра нуклеофильными реагентами;
· атом кислорода, богатый электронами, может выступать как в качестве основания, так и в качестве
· нуклеофила.
Спирты проявляют слабые кислотные свойства (они значительно слабее воды), поэтому классическая реакция со щелочами полностью сдвинута влево и образование алкоголятов в этих условиях не происходит.
![]()
Алкоголяты щелочных металлов получают растворением последних в спирте при комнатной температуре. Для получения алкголятов алюминия необходимо кипячение реакционной смеси.
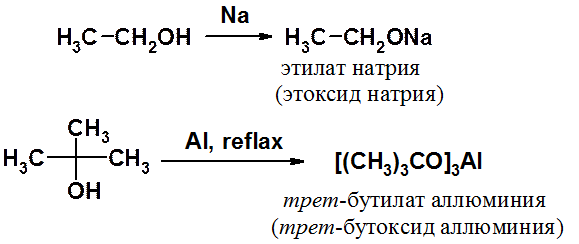
Кислотность спиртов уменьшается в ряду:
метанол > первичные > вторичные > третичные.
Основность спиртов проявляется в образовании оксониевого катиона при взомодействии с сильными кислотами.
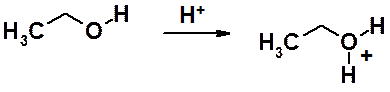
Способность спиртов образовывать оксониевые катионы, лежит в основе многих реакций, в которых плохую уходящую группу –ОН, в условиях реакции кислым катализом превращают в хорошую уходящую группу - Н2О.
Реакция проходит под действием серной кислоты при нагревании. В спиртах, в отличие от галогеноалканов, элиминирование протекает по мономолекулрному механизму (Е1).

Особенности реакций нуклеофильного замещения подробно рассмотрены в разделе «Галогенопроизводные». Замещение гидрокси-группы на галоген – реакция обратная рассмотренной выше, проходящая по тем же основным закономерностям SN реакций. Замещение ОН-группы на галоген может быть выполнено несколькими путями. Самый простой, но не самый лучший (т.к. возможны перегруппировки и другие побочные реакции) – действием галогеноводородной кислоты на соответствующий спирт. Особенность превращения в том, что сначала происходит активация субстрата, посредством протонирования. В дальнейшем происходит замещение воды, а не ОН-группы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.