· Алкины. Гомологический ряд, номенклатура, изомерия. Молекулярная структура ацетилена: sp-гибридизация, параметры связей СºС и С-Н (энергия, полярность, поляризуемость). Физические свойства алкинов, способы их идентификации и спектральные характеристики.
· Методы получения: промышленные методы получения ацетилена, из дигалогеналканов или винилгалогенидов, из ацетилена и галогеналканов.
· СН-кислотность алкинов. Реакции, протекающие без разрыва тройной связи: получение ацетиленидов, взаимодействие ацетиленидов с галогеналканами, карбонильными соединениями.
Алкины – непредельные углеводороды, два атома углерода которых связаны тройной (1 s- и 2 p-) связью. Формула гомологического ряда алкинов СnH2n-2. Простейший представитель алкинов – ацетилен С2Н2, поэтому их часто называют ацетиленовыми углеводородами.
Тройная связь образована углеродами, находящимися в sp-гибридизованном состоянии. Строение тройной связи, ее геометрические и энергетические параметры подробно рассмотрены ранее (см. лекцию 2).
Поскольку тройная связь образована линеарногибридизованными атомами углерода, в алкинах отсутствует геометрическая изомерия, характерная для алкенов. Изомерия алкинов связана только с различиями в углеродном скелете молекулы и положении тройной связи. Возможна межклассовая изомерия (алкины и алкадиены).

Простейший представитель ряда – ацетилен. По номенклатуре IUPAC названия алкинов образуют также, как алкенов, только используют окончание –ин вместо –ен. Низшие члены гомологического ряда, имеющие простое строение, часто называют как производные ацетилена, у которого один или оба атома водорода замещены на алкильные группы.
Одно из наиболее важных в химическом отношении органических соединений – ацетилен. Его основной промышленный способ получения базируется на методе, открытом в 1862 г. Ф. Вёлером. Отличительная особенность этого синтеза – использование дешевого и доступного сырья (уголь, известняк и вода) и простых в препаративном отношении реакций.
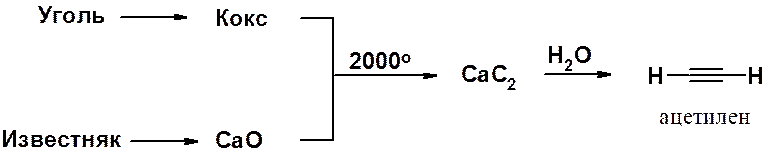
Оксид кальция и кокс в электрических печах превращают в карбид кальция, гидролиз которого дает ацетилен.
В другом, менее распространенном способе исходят из природного газа. Частичное окисление метана при высокой температуре приводит к ацетилену.
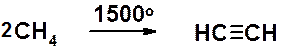
В органической химии есть два основных подхода к синтезу:
· в соединении с целевым углеродным скелетом создают необходимую функциональную группу;
· на основе вещества с нужной функцией строят соединение с заданной углеродной структурой.
Оба этих подхода могут быть успешно использованы при синтезе гомологов ацетилена.
Дегидрогалогенирование дигалогенопроизводных. В этом методе возможно использование как вицинальных, так и геминальных алкилдигалогенидов.
Отщепление галогеноводорода от вицинальных производных имеет важное значение, т.к. исходные дигалогенопроизводные могут легко быть получены присоединением галогена к соответствующему алкену. Суммарно это метод превращения алкенов в алкины:
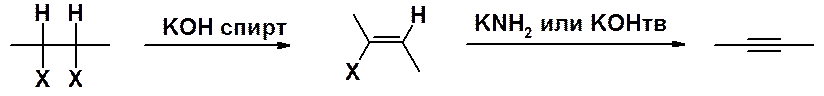
В результате первой стадии элиминирования образуются ненасыщенные галогенопроизводные – винилгалогениды. Галоген в этих соединения инертен, в том числе и в реакциях элиминирования. Отщепление галогеноводорода от винилгалогенидов требует применения более жестких условий синтеза – использование сильных оснований, например, твердых щелочей при высокой температуре и повышенном давлении или амидов.
Двухстадийное элиминирование геминальных дигалогенопроизводных приводит к аналогичным результатам.

Дегалогенирование тетрагалогенопроизводных. Этот метод синтеза алкинов используют очень редко, т.к. сами тетрагалогениды получают из алкинов.
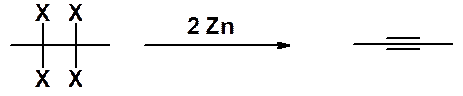
Такое превращение может быть использовано для защиты тройной связи. Сначала алкин превращают в тетрагалогенопроизводное. Затем проводят реакции в другом реакционном центре молекулы, после чего регенерируют тройную связь.
Алкилирование ацетиленидов. Это метод, позволяющий удлинить углеродную цепь алкина:
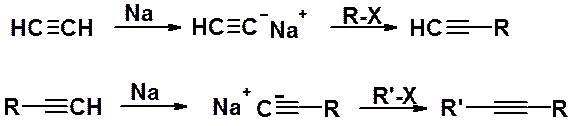
В реакции могут быть использованы как сам ацетилен, так и его гомологи с терминальной тройной связью. Наилучшие результаты дают реакции с первичными галогеноалканами, т.к. вторичные и третичные производные вступают в конкурирующую реакцию элиминирования.
По Бренстеду-Лоури кислота – соединение, способное отдать протон (Н+), а кислотность – мера склонности кислоты к такому процессу. Высокая кислотность характерна для веществ, в которых водород связан с сильно электроотрицательным атомом, чаще всего с кислородом, галогеном, серой, азотом. В этом случае электронная плотность связи сильно сдвинута в сторону гетероатома, что приводит к легкому отщеплению протона. Кроме того, электроотрицательный элемент после отщепления протона лучше удерживает пару электронов, что приводит к увеличению стабильности образующегося аниона и, следовательно, к большей кислотности. При рассмотрении электроотрицательности в ряду F > O > N > C не вызывает удивления, что HF - достаточно сильная кислота, H2O значительно слабее, NH3 чрезвычайно слабая, а СН4 вообще не считают кислотой, поскольку нет оснований, способных оторвать протон от алкана.
Как сам ацетилен, так и его гомологи с концевой тройной углерод-углеродной связью являются слабыми СН-кислотами, способными быть донорами протона при взаимодействии с сильными основаниями. Например, в реакции ацетилена с металлическим натрием или амидом натрия образуется ацетиленид натрия.
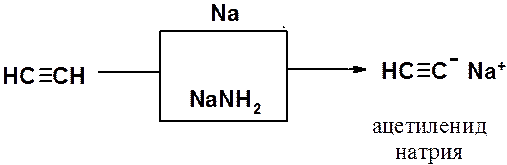
Алкины проявляют кислые свойства только в апротонных безводных растворителях. Это объясняется тем, что кислые свойства ацетиленовых углеводородов с концевой тройной связью выражены значительно слабее, чем у воды, а связь углерод-металл ближе к ионной, чем к ковалентной. Вода мгновенно гидролизует ацетилениды щелочных металлов.
![]()
Связь С-Н в алкинах образована за счет перекрывания 1s электрона атома водорода и орбитали углерода, находящегося в sp-гибридизованном состоянии. Такой углеродный атом проявляет большую электронную акцепторность, чем sp2- и sp3-гибридизованные атомы и лучше удерживает электроны. В сравнении с sp3-орбиталью, sp-орбиталь обладает более выраженным s характером: она меньше по размеру (см. Введение) и электрон лучше удерживается атомом. В результате ацетиленид-анион, пара электронов которого находится на sp-орбитали, обладает большей относительной устойчивостью (имеет меньшую энергию), чем винильный или алкильный катион.
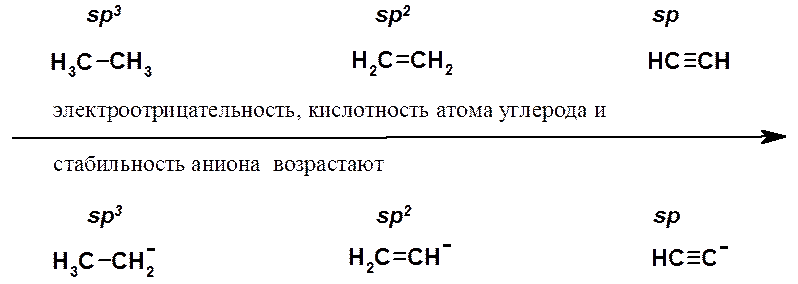
Кроме ацетиленидов щелочных металлов в синтезе часто используют магниевые производные, получаемые реакцией алкинов с реактивами Гриньяра (реактивы Ж.Иоцича).
![]()
Во многих случаях реактивы Иоцича более удобны в синтезе, чем ацетилениды щелочных металлов. Обладая высокой реакционной способностью, они заметно более устойчивы, с ними проще проводить реакции.
Алкины с концевой тройной связью могут реагировать с ионами тяжелых металлов с образованием соответствующих ацетиленидов. Так, ацетилен и его гомологи реагируют с аммиачным раствором оксида серебра или хлорида одновалентной меди с образованием соответствующих ацетиленидов.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.