Молекулярная формула указывает на значительную непредельность бензола. Однако было быстро установлено, что в реакции, характерные для непредельных соединений, бензол не вступает. Классические реакции алкенов, диенов и их циклических аналогов: галогенирование, гидроксилирование, гидратация и др. неосуществимы в ароматическом ряду. Бензол, вступая в реакцию с бромом (в присутствии катализатора), образует не продукт присоединения, а продукт замещения водорода. Вообще для большинства ароматических соединений характерны реакции замещения. Реакции присоединения являются исключением и не характерны для бензола и его гомологов.
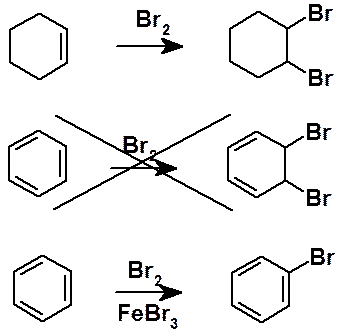
Еще один экспериментальный факт. Энергию непредельных соединений очень часто оценивают по теплоте гидрирования – количеству тепла, выделяющегося при присоединении к двойной связи молекулы водорода. При гидрировании циклогексена выделяется 28,6 ккал/моль. Следовательно, при гидрировании циклогексадиена и циклогексатриена следует ожидать 57,2 и 85,8 ккал/моль соответственно.
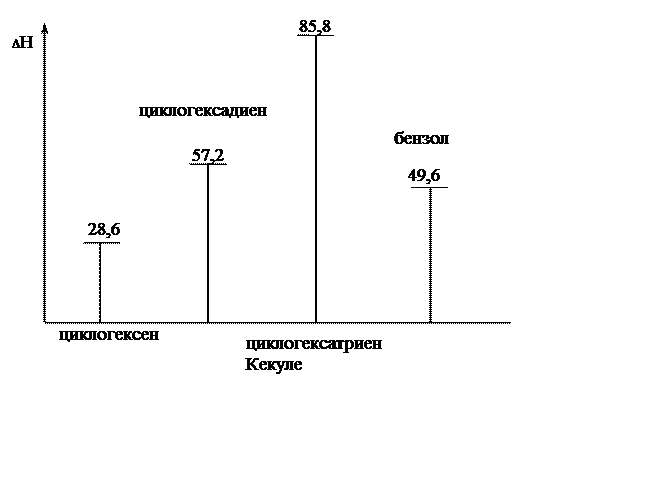 |
Рис. 17.1. Теплоты гидрирования циклоенов и бензола
Из рис. 17.1 ясно, что бензол значительно более устойчив, чем гипотетический циклогексатриен Кекуле. Длины всех углерод-углеродных связей в бензоле одинаковы и равны 1,39 Å. Т.е. бензольное кольцо – правильный шестиугольник, все атомы лежат в одной плоскости, нет ни простых, ни двойных связей.
Строение бензола стало понятным только в 30-х года XX века, после появления теории резонанса Л. Полинга (см. лекцию «Диены»). Бензол нельзя описать одной структурной формулой, поэтому используется набор граничных структур:

Граничные структуры не существуют. Они показывают возможное, не действительное, расположение p-электронов. Реальная молекула – суперпозиция (наложение) граничных структур.
В бензоле все атомы углерода находятся в sp2-гибридизованном состоянии. Все лежат в одной плоскости. Каждый из атомов С имеет одну негибридизованную р-орбиталь, состоящую из двух одинаковых долей, одна из которых находится над плоскостью, а другая – под плоскостью кольца. р-Орбитали каждого атома перекрываются с р-орбиталями соседей. Образуются два торообразных электронных облака (над и под плоскостью цикла). Это система из 6 делокализованных p-электронов. Важно, что в случае бензола невозможно сказать, какая пара электронов принадлежит каким двум атомам углерода. В бензоле 6 p-электронов делокализованы, т.е. принадлежат в равной степени всем шести атомам углерода кольца. На рис 17.2. показаны длины связей, валентные углы и форма p-электронных облаков в молекуле бензола.
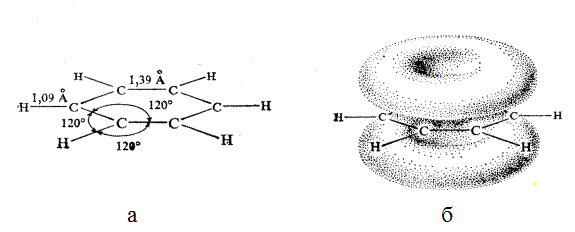
Рис. 17.2. Форма и размеры (а) и форма p-электронных облаков (б) молекулы бензола.
Показанное строение бензола прекрасно объясняет приведенные выше свойства. Делокализация всегда рассматривается как стабилизирующий фактор и благодаря равномерному распределению p-электронов бензол на 36 ккал/моль устойчивее гипотетического циклогексатриена. Реакции присоединения нарушают делокализацию p-электронов, что энергетически невыгодно (см. рис. 17.1). В реакциях замещения сопряжение сохраняется. Разница в энергии между несопряженной молекулой и системой с делокализованными электронами называется энергией делокализации (сопряжения, резонанса). Это энергия, которую необходимо затратить на разрушение системы сопряженных связей. Чем больше энергия делокализации, тем больше выигрыш в энергии.
Бензол - первый и простейший пример соединений ароматического ряда. Говорят о веществах, проявляющих ароматический характер. Очень важно понимать, что такое ароматичность и на основании каких структурных и других требований вещество может быть отнесено к этой группе.
Единодушно принятого определения ароматичности не существует. Собственно понятие «ароматичность» означает совокупность структурных, энергетических свойств и реакционной способности циклических структур с системой сопряженных связей. Одно из наиболее современных определений ароматичности: ненасыщенная циклическая или полициклическая молекула или ион может рассматриваться как ароматическая, если все атомы цикла входят в полностью сопряженную систему таким образом, что в основном состоянии все π-электроны располагаются только на связывающих молекулярных орбиталях замкнутой оболочки (Реутов, Курц, Бутин, ОХ, т.2).
Структурные критерии ароматичности:
· циклическая молекула;
· плоская молекула;
· непрерывная цепь сопряжения;
· в моноциклической системе число участвующих в сопряжении p-электронов равно 4n + 2, где n=0,1,2… (правило Э. Хюккеля). (т.е. 2, 6, 10, 14 и т.д. электронов).
Склонность к реакциям замещения – признак ароматичности, а не критерий.
Из приведенных ниже веществ только бензол удовлетворяет всем структурным критериям.
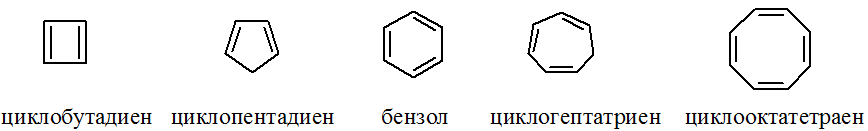
В молекулах циклопентадиена и циклогептатриена есть разрыв в цепи сопряжения (имеется sp3-углерод). В молекулах циклобутадиена и циклооктатетраена число p-электронов не соответствует правилу Хюккеля.
Структурные критерии не ограничивают ароматические соединения бензолом и его производными. Существуют небензоидные ароматические соединения. Например:

Существует огромное количество полициклических соединений, обладающих ароматическими свойствами:

Бензол существует в виде единственного изомера. Дизамещенные бензолы – в виде трех изомеров: орто-, мета- и пара-.
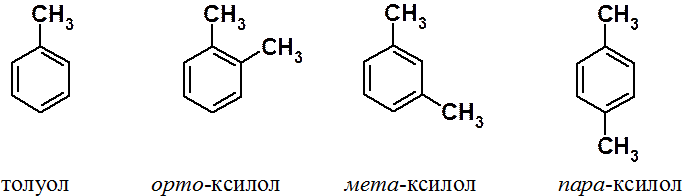
Основные промышленные источники бензола и его гомологов – каменноугольная смола и нефть.
Синтетически бензол может быть получен дегидрированием циклогексана, тримеризацией ацетилена и декарбоксилированием бензойной кислоты.
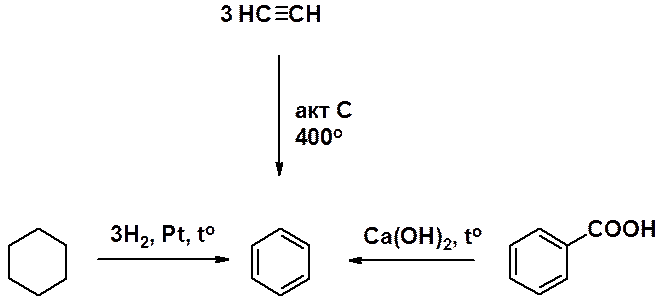
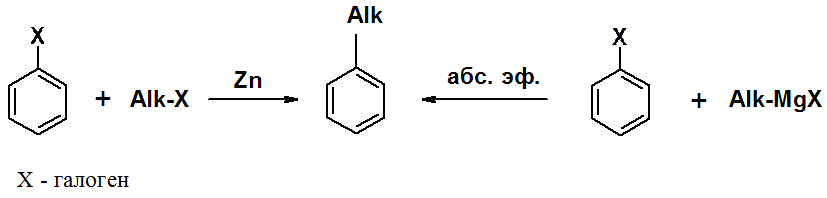
Гомологи бензола могут быть получены алкилированием бензола по реакциям Фриделя-Крафтса (будет рассмотрена далее), Вюрца-Фиттига (аналог реакции Вюрца в алканах) и Вюрца-Гриньяра.
· Реакция ароматического электрофильного замещения (SEAr). Механизм, понятие о p- и s-комплексах. Энергетические характеристики реакций SEAr. Экспериментальные доказательства механизма. Примеры SE реакций: нитрование, галогенирование, алкилирование и ацилирование по Фриделю-Крафтсу, сульфирование. Особенности этих реакций.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.