В конформации «кресло» 6 атомов водорода перпендикулярны усредненной плоскости кольца и называются аксиальными (a-), а 6 других находятся близко к этой условной плоскости и называются экваториальными (e-). Если заместить один из водородов на алкильную или какую-нибудь функциональную группу, она может находиться в экваториальном или аксиальном положении. При комнатной температуре существует единственный циклогексан, а не два изомера. Причина этого – быстрая инверсия цикла, в результате которой метильная группа из аксиальной становится экваториальной.
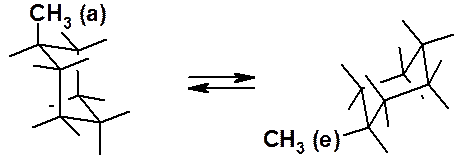
Рис. 16.3. Инверсия метилциклогексана
Циклопентан по Байеру практически не имеет углового напряжения. Однако даже он существует не в планарной форме, т.к. в плоской молекуле все атомы водорода будут находиться в заслоненной конформации, что приведет к заметному торсионному напряжению. Энергетически более выгодно существование циклопентана в виде так называемого «конверта», в котором 4 атома углерода находятся в одной плоскости, а пятый выходит из нее.
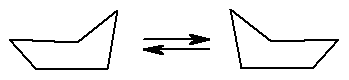
Рис. 16.4. Конформационные изменения циклопентана
Циклобутан также неплоский, он представляет собой два равносторонних треугольника, соединенных по одной из сторон и располагающихся в разных плоскостях. Причина выхода двух атомов углерода из плоскости все в той же заслоненной конформации метиленовых групп, которая энергетически невыгодна.
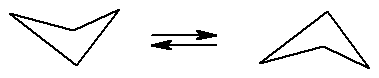
Рис. 16.5. Конформационные изменения циклобутана
В циклопропане атомы углерода не могут находиться в разных плоскостях (геометрическое место трех точек – плоскость). Молекулу можно представить как правильный треугольник. Однако экспериментальные данные показывают, что циклопропан ведет себя так, как если бы угол между С-С связями составлял 102о. Невозможно представить себе правильный треугольник с внутренними углами не равными 60о.
Перекрывание атомных гибридизованных орбиталей в молекуле циклопропана показано на рис. 16.6. Как видно, связь образуется не по линии, связывающей центры атомов. Такие связи называют «банановыми» или изогнутыми. По своим характеристикам они занимают промежуточное положение между s- и p-связями. Этот факт объясняет частичную ненасыщенность циклопропана.
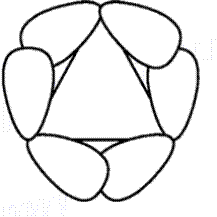
Рис. 16.6. Перекрывание атомных орбиталей в молекуле циклопропана
Некоторые алициклические производные широко используются в промышленности. В первую очередь это относится к производным циклогексана. Исходным сырьем для синтеза многотоннажных продуктов служит циклогексанон, получаемый в промышленности из доступного фенола.
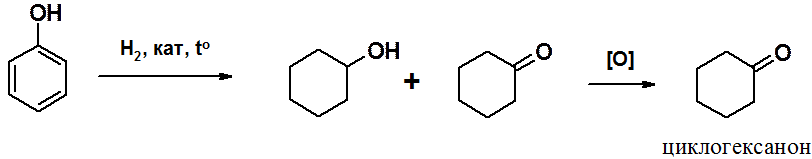
Каталитическое гидрирование фенола приводит к смеси циклогексанола и циклогексанона, которую, без предварительного разделения, окисляют, получая циклогексанон.
Два основных направления использования циклогексанона:
1. В присутствии окислителей циклогексанон легко превращается в адипиновую кислоту, которую затем вводят в реакцию поликонденсации с гексаметилендиамином с целью получения найлона:
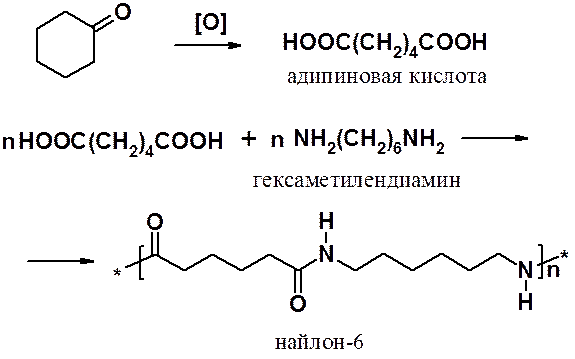
2. Реакция циклогексанона с гидроксиламином приводит к оксиму циклогексанона. Последний под действием серной кислоты претерпевает перегруппировку Бекмана, превращаясь в капролактам, который гидролизуют, получая e-аминокапроновую кислоту. Поликонденсация аминокапроновой кислоты приводит к капрону.
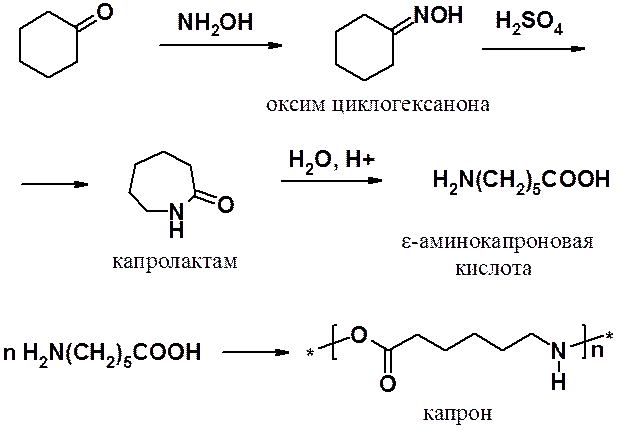
Из непредельных соединений алициклического ряда следует отметить одно вещество – циклопентадиен-1,3. Это вещество будет рассмотрено в разделе ароматические углеводороды. Здесь следует отметить следующее:
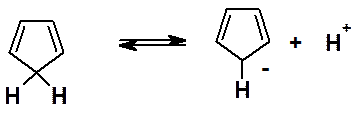
· Циклопентадиен существует в виде димера, который образуется в результате реакции Дильса-Альдера. Для получения самого циклопентадиена димер перегоняют.

· Циклопентадиен необычайно легко отдает протон (проявляет высокую кислотность), что совершенно не характерно для углеводородов (причины этого будут рассмотрены в следующем разделе).
· Бензол и его гомологи. Изомерия, номенклатура. Молекулярная структура бензола. Формула Кекуле. Современные представления о строении бензола. Ароматичность и комплекс свойств, характеризующих ее. Энергия делокализации. Правило Хюккеля, небензоидные ароматические системы. Физические свойства и спектральные характеристики бензола и его гомологов.
· Синтетические методы получения: тримеризация ацетиленовых углеводородов, дегидрирование алициклических углеводородов, реакции алкилирования (по Фриделю-Крафтсу, Вюрцу-Фиттигу, Вюрцу-Гриньяру). Природные источники ароматических углеводородов (ароматизация нефти и коксование угля).
Существует большое количество органических соединений, имеющих простейшую эмпирическую формулу СН. Среди них вещества самых разных классов, с разными свойствами. В том числе и ароматические соединения. Наиболее известное ароматическое соединение – бензол. Термин «ароматический» не означает хороший запах. Нюхать их категорически запрещено, так как они очень токсичны. Сам бензол – нервный, кроветворный (печеночный) и плацентарный яд. В России федеральным законом женщинам запрещено работать с бензолом.
Бензол был получен в 1825 г. М. Фарадеем и синтезирован из бензойной кислоты Э.Митчерлихом в 1834 г. Молекулярная формула С6Н6 была определена очень быстро. Структура долго оставалась загадкой. Только в 1865 г. А.Кекуле предложил циклогексатриеновую структурную формулу бензола, которую используют и в настоящее время, вкладывая в нее другой смысл.

Молекулярная формула бензола, как и предложенная Кекуле формула, уже в XIX веке противоречила экспериментальным фактам.
В соответствии с формулой Кекуле 1,2-дизамещенные бензолы должны существовать в виде двух изомеров. Однако известен единственный орто-дихлорбензол.
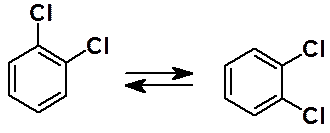
Для объяснения этого факта была выдвинута теория осцилляции (перемещения) двойных связей (показано стрелками обратимости). Т.е. двойные связи так быстро меняются местами, что мы фиксируем только один изомер.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.