Енол и карбонильное соединение – изомеры, отличающиеся расположением пары p-электронов, атома водорода и находящиеся в равновесии. Такие изомеры называются таутомерами, а само явление – таутомерией.
Образующийся в ходе гидратации алкина енол не удается выделить, поскольку таутомерное равновесие всегда сильно сдвинуто в стороны кето-формы.
Перегруппировка енола в кето-форму протекает вследствие высокой полярности связи О-Н, что приводит к легкому отщеплению протона гидроксильной группы.

Далее протон может присоединиться либо обратно к кислороду енолят-аниона, либо к углероду. Если он присоединится к углеродному атому, то образуется менее кислое соединение, в котором протон не демонстрирует выраженное стремление к диссоциации. Так в реакционной смеси накапливается кето-форма.
Есть единственный случай, когда в реакции Кучерова образуется альдегид – гидратация самого ацетилена. Во всех других реакциях получаются кетоны.
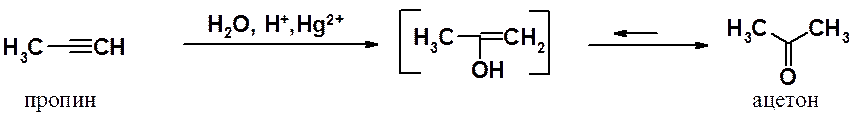
Гидратация пропина приводит к ацетону, а не к пропионовому альдегиду.
Реакции нуклеофильного присоединения. Алкины способны в присутствии катализатора присоединять нуклеофильные реагенты. В результате образуются винильные производные разных классов. Эти реакции называют реакциями винилирования.
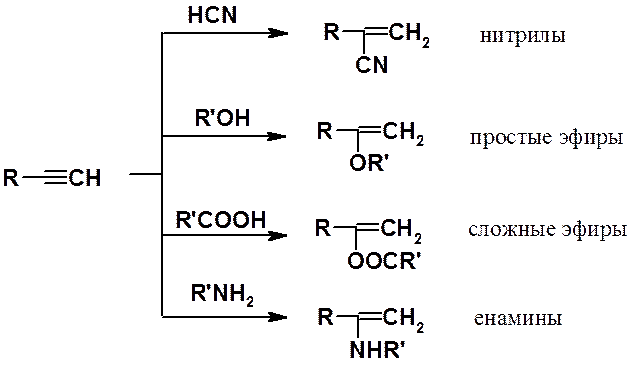
Некоторые реакции нуклеофильного присоединения к алкинам показаны выше. Они часто используются для получения соединений, служащих мономерами в синтезе ВМС. Например, реакция ацетилена с н-бутанолом приводит к бутилвиниловому эфиру, полимеризацией которого получают винилин (бальзам Шостаковского) - ценное лекарственное средство.
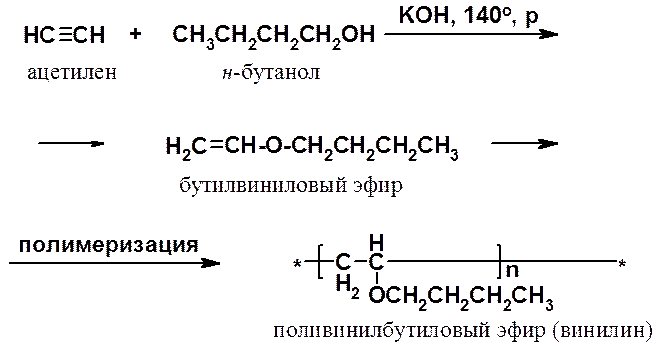
Окисление. Как все органические соединения, содержащие кратные углерод-углеродные связи, алкины легко подвергаются окислению самыми различными окислителями, например перманганатом или дихроматом калия. Реакция протекает с полным разрывом тройной связи и образованием карбоновых кислот (алкины с концевой тройной связью образуют карбоновую кислоту и углекислый газ).
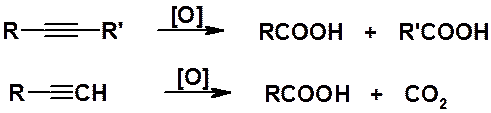
Эти реакции могут быть использованы для определения строения алкинов.
Некоторые окислители, например диоксид селена, позволяют проводить селективное окисление алкинов, в ходе которого происходит расщепление только p-связей. При этом дизамещенные алкины превращаются в a-дикетоны, а монозамещенные - в a-кетокислоты.
Полимеризация алкинов. В ряду алкинов наибольший интерес представляют реакции ди-, тримеризациии, а также циклотри- и циклотетрамеризации.
Линейные ди- и тримеры ацетилена, имеющие большое промышленное значение, могут быть получены в присутствии солей одновалентной меди.
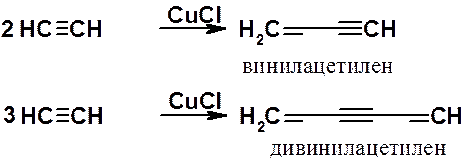
Винилацетилен является исходным соединением для синтеза хлоропрена (2-хлорбутадиена-1,3), полимеризацией которого получают хлоропреновый каучук.
Циклотримеризация ацетилена, приводящая к бензолу, была открыта в 1866 г. М.Бертло и модифицирована Н.Д. Зелинским и Б.А. Казанским (1922 г.).
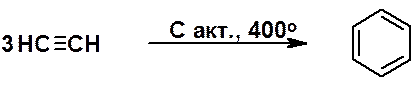
Циклотетрамеризация открыта В. Реппе (1949 г.).
· Алкадиены. Классификация, номенклатура, типы диенов. Строение 1,3-диенов: сопряжение p-связей, понятие о делокализованных связях, использование предельных структур для описания строения бутадиена, качественные критерии их относительного вклада, энергия сопряжения. Физические свойства сопряженных алкадиенов, их спектральные характеристики и способы идентификации.
· Методы получения сопряженных диенов: метод Лебедева, дегидратацией спиртов, из бутан-бутеновой фракции нефти.
Диены - соединения, содержащие в молекуле две двойные углерод-углеродные связи. Общая формула гомологического ряда CnH2n-2.
В зависимости от расположения двойных углерод-углеродных связей, диены делят на три группы:
1) диены с кумулированными (примыкающими) двойными связями, например, СН2=С=СН2 (пропадиен, аллен);
2) диены с сопряженными двойными связями, например, СН2=СН-СН=СН2 (бутадиен-1,3);
3) диены с изолированными двойными связями, например,СН2=СН-СН2-СН=СН2 (пентадиен-1,4).
Диены с кумулированными двойными связями являются изомерами алкинов (например, пропин и пропадиен), в которые они превращаются при нагревании в присутствии щелочей.

Диены с изолированными связями по своему строению и химическим свойствам практически не отличаются от алкенов. Для них характерны реакции электрофильного присоединения, которые могут проходить ступенчато.
Наибольшее теоретическое и прикладное значение имеют сопряженные диены.
Вообще, в органической химии системами с сопряженными связями называют такие молекулы, в которых кратные связи разделены одной простой (s-) связью. Простейшая из сопряженных систем - бутадиен-1,3 или С4Н6. Исходя из изложенных ранее представлений о строении одинарной, двойной и тройной связи, строение бутадиена не выглядит сложным. Четыре атома углерода находятся в sp2-гибридизованном состоянии и связаны с тремя соседними атомами s-связями. Кроме того, перекрывание негибридизованных 2р-орбиталей между С-1 и С-2, а также между С-3 и С-4 атомами углерода приводит к образованию двух сопряженных p-связей.
Однако строение молекулы бутадиена значительно сложнее. Установлено, что все атомы углерода и водорода лежат в одной плоскости, в которой находятся также все s-связи. Негибридизованные p-орбитали перпендикулярны этой плоскости. Расстояние между углеродами С-1 и С-2, как и между атомами С-3 и С-4, равно 0,134 нм, что немного больше длины двойной связи в этилене (0,133 нм), а расстояние между атомами С-2 и С-3, равное 0,147 нм, - значительно меньше s-связи в алканах (0,154 нм).
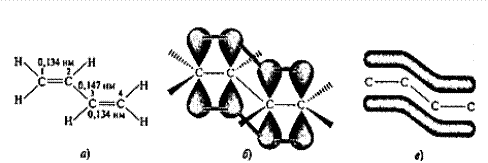
Рис. 14.1. Длина связей (а), перекрывание р-орбиталей (б) и делокализованная МО (в) молекулы бутадиена-1,3
Экспериментальные данные показали, что бутадиен-1,3 устойчивее, чем ожидалось. Энергию непредельных соединений часто оценивают по теплоте гидрирования. Присоединение молекулы водорода к двойной углерод-углеродной связи, т.е. превращение непредельного соединения в насыщенное, сопровождается выделением тепла. При гидрировании изолированной двойной связи выделяется около 127 кДж/моль. Следовательно, при гидрировании двух двойных связей следует ожидать выделения 254 кДж/моль. Именно столько тепла выделяется при гидрировании пентадиена-1,4 – соединения с изолированными двойными связями. Гидрирование же бутадиена-1,3 дало неожиданный результат. Теплота гидрирования оказалась всего 239 кДж/моль, что на 15 кДж/моль меньше ожидаемой. Это означает, что бутадиен содержит меньше энергии (более устойчив), чем ожидалось.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.