МВС и ВВС очень сильно влияют на свойства салициловой кислоты. Так салициловая кислота является более сильной кислотой, чем ее мета- и пара-аналоги, поскольку водородная связь с гидроксильной группой частично насыщает притяжение протона к карбоксильному иону. Еще более отчетливо этот эффект проявляется в 2,6-гидроскибензойной кислоте со структурой (рис. 2.7.):
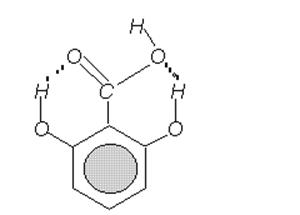
Рис. 2.7. ВВС в 2,6-гидроксибензойной кислоте.
Это вещество является очень сильной кислотой, более сильной, чем фосфорная и серная; константа диссоциации имеет значение 5·10-2.
В кристаллах о-, м- и п-гидроксибензойных кислот образуются водородные связи между молекулами (в орто-соединении внутри молекулы), тогда как в паре кольцевание внутри молекулы возможно только в орто-соединении. Поэтому авторы ожидали, что теплота испарения салициловой кислоты будет меньше, чем для ее аналогов; другие родственные свойства также будут отличаться. Это действительно и наблюдалось в эксперименте: упругости пара этих веществ при 100оС относятся как 1320:5:1. Величины RTln(1320/5) и RТln(1320/1) имеют, соответственно, значения 4.16 и 5.36 ккал/ мол; отсюда автор заключил, что энергия водородной связи в молекуле о-гидроксибензойной кислоты равна приблизительно 4.7 ккал/ мол. При таком выводе Паулинг основывался на предположении, что значения свободной энергии для всех трех кристаллов одинаковы, а значения свободной энергии газов отличаются только на величину водородной связи в орто-соединении.
По этим же причинам салициловая кислота является значительно более сильной (на 2 порядка [52]), чем бензойная, ее константа диссоциации К25=1.06·10-3 [50].
ИК-спектры салициловой кислоты в кристаллическом состоянии были исследованы в работе [57]. В соответствии с димерной структурой в спектре салициловой кислоты в области карбонильного поглощения в растворах CCl4 при концентрациях 0.01-0.005 мол/л авторы наблюдали две полосы, относящиеся к димерам (1662 см-1) и к мономерам (1696 см-1) с ВВС. Сдвиг частоты карбонильной группы, связанный с мономер-димерным равновесием, составляет здесь 34 см-1, что значительно меньше, чем, например, для бензойной кислоты (45 см-1). Это обусловлено ослаблением из-за наличия ВВС электронодонорных свойств неподеленной пары кислорода карбонильной группы, ответственной за образование димеров.
В работах [58, 59] с целью выяснения состояния молекул салициловой кислоты (мономеры или димеры) в газовой фазе авторы исследовали ИК-спектры поглощения парообразной салициловой кислоты. В твердом состоянии исследованные в данной работе ароматические соединения ассоциированы водородными связями. В их ИК-спектрах нет полос свободных групп ОН. Полосы валентных колебаний фенольной гидроксильной группы у всех изомеров оксибензойной кислоты сдвинуты в низкочастотную область. Более сильное по сравнению с пара- и мета-оксибензойными кислотами понижение частот n(С=О) и n(ОН) фенольного гидроксила в случае салициловой кислоты объясняется авторами наличием ВВС. В спектрах парообразных оксибензойных кислот в области 2500-3000 см-1 не обнаружены какие-либо полосы поглощения, характерные для димеров кислот. Значения n(ОН) карбоксильной группы разных по силе кислот в газовой фазе почти совпадают. Исходя из полученных данных, авторами был сделан вывод о том, что при переходе от кристаллического соединения к парообразному МВС разрушаются: в газовой фазе доминируют мономеры. При переходе от ИК-спектра твердой салициловой кислоты к парообразной менее чувствительной к изменению оказывается частота валентного колебания фенольного гидроксила. Мало меняется и частота валентного колебания карбонильной группы в сравнении с аналогичной для бензойной кислоты (таблица 2.2), что указывает на сохранение ВВС между гидроксильной фенольной и карбонильной группами в мономере салициловой кислоты и в парообразном состоянии.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.