Длины связей С-С и С-О не отличаются от найденных для других ассоциированных карбоновых кислот. Длины связей С-Н 0.86±0.05 и О-Н 0.97±0.06А значительно меньше обычных (1.07 и 1.04-1.12А). Максимумы атомов Н, связанных с О, содержат значительно меньше электронов, чем максимумы остальных атомов Н, что авторами [53] истолковано как переход электронов 0.67 э от атома Н к атому О (дипольный момент нормальной связи О-Н указывает на переход 0.2 э ; больший переход в данном случае объясняется внутримолекулярной водородной связью, которая является также более сильной кислотой в сравнении с п- и м-изомерами).
2.2. Получение салициловой кислоты
В промышленном масштабе салициловую кислоту получают по способу Кольбе, усовершенствованному Шмидтом, нагреванием фенолята натрия с углекислотой в автоклаве (способ Кольбе-Шмитта) при давлении 0.6 Мпа , температуре 185ОС в течение 8¸10 часов [51]:
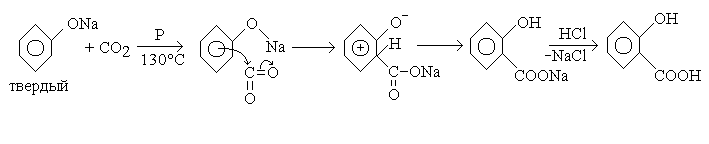
Рис. 2. 4. Схема получения салициловой кислоты способом Кольбе - Шмитта.
В работе [54] для решения вопроса о том, происходит ли карбоксилирование фенолятов через стадию образования угольных солей, авторами был применен метод меченного углерода 14С (действием 14СО2 на натрий фенолят). Полученные кислоты имели радиоактивность ниже или равную рассчитанной для полного обмена. Оставшиеся арилугольные соли теряли значительную часть активности вследствие обмена с газовой фазой. Контрольными опытами было показано, что соли салициловой кислоты не обмениваются углеродом с СО2 в условиях опыта. Таким образом, авторами был сделан вывод, что феноляты карбоксилируются непосредственно углекислотой, минуя стадию образования арилугольных солей.
Также механизм синтеза салициловой кислоты был рассмотрен в работе [55], где авторы рассматривали вопрос о причинах альтернативного образования монозамещенных или дизамещенных солей при карбоксилировании фенолятов. В результате работы было установлено, что синтез салициловой кислоты протекает через образование динатриевой соли салициловой кислоты непосредственно из фенолята натрия и СО2. Образовавшийся в закрытом сосуде фенол, действующий как протон-акцептор, реагирует с динатриевой солью, образуя моносоль салициловой кислоты, благодаря чему ее выход приближается к теоретическому. Этот вывод авторы подтверждают наблюдением, что мононатриевая соль салициловой кислоты устойчива в присутствии фенолята натрия при 140ОС, а фенол реагирует с динатриевой солью, образуя натрий салицилат.
При осторожном нагревании салициловая кислота возгоняется, при более сильном нагревании расщепляется на фенол и угольную кислоту, причем фенол вступает в реакцию с салициловой кислотой, образуя сложный эфир НО-С6Н5-СО-ОС6Н5 (салол) [50].
При более высоких температурах (250-300ОС), особенно с фенолятом калия, образуется пара-изомер салициловой кислоты [52] (рис. 2. 5):
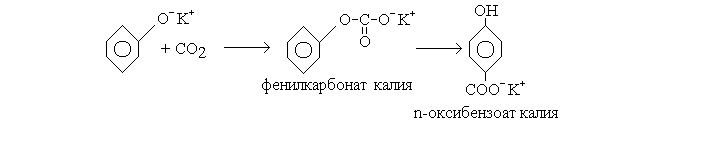
Рис. 2.5. Образование пара-изомера салициловой кислоты.
2.3. Строение салициловой кислоты
Более детально влияние внутримолекулярной связи на свойства салициловой кислоты было рассмотрено в работе Паулинга [56]. В данной работе исследовались димерные молекулы, образованные салициловой кислотой, в таких растворителях, как бензол и четыреххлористый углерод. Используя спектроскопический метод, в работе показано, что димерные молекулы не содержат групп ОН, которые не участвовали бы в образовании водородных связей.
По мнению автора это приводит к следующей структуре молекулы (рис. 2.6.):
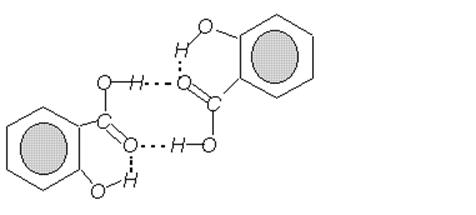
Рис. 2.6. Структура межмолекулярных и внутримолекулярных водородных связей салициловой кислоты.
Аналогичные структуры, наблюдаемые в кристаллическом состоянии и в не очень разбавленных растворах, определяют химические и биологические свойства этого соединения [57].
В данной структуре две карбоксильные группы соединены межмолекулярными водородными связями (МВС) и, кроме того, каждая гидроксильная группа связана с атомом кислорода соседней карбоксильной группы посредством внутримолекулярной водородной связи (ВВС).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.