Таблица 2.2. Частоты n (С=О) и n (ОН) в ИК-спектрах поглощения бензойной кислоты и ароматических оксисоединений в твердом и парообразных состояниях (см-1)
|
Соединение |
Кристаллы n(С=О) n(ОН)ф.гр. |
Пары n(С=О) n(ОН)ф.гр n(ОН)ф.гр |
|
Фенол |
3657 |
|
|
Бензойная к-та |
1685 |
1765, 1757 3579 |
|
п-Оксибензойная к-та |
1672 3384 |
1753 3573 3635 |
|
м-Оксибензойная к-та |
1713,1690 3272 |
1760 3582 3650 |
|
о- Оксибензойная (салициловая) к-та |
1658 3234 |
1723, 1696 3574 3262 |
2.4. Комплексообразование салицилат-иона
Наличие в молекулах оксикислот двух функциональных групп(-ОН и СООН) определяет их высокую комплексообразующую способность. Наиболее ярко комплексообразующие свойства салициловая кислота проявляет в слабощелочной среде [52] (рис. 2.8):
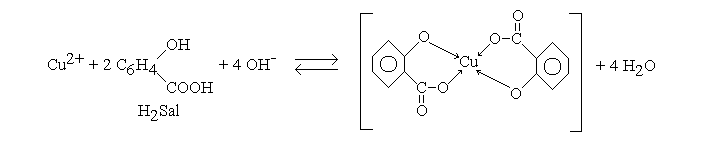
Рис. 2.8. Образование салицилат-ионом хелатного комплекса с медью.
Высокая устойчивость салицилатных комплексов (так log Ку для [Cu(Sal)2]2- и [Cu(Sal)3]3- соответственно 16.9 и 33.55) обусловлена образованием хелатных комплексов с p- и d-металлами, в которых ион металла оказывается заключенным в ионно-ковалентные “клешни”, которые пространственно экранируют ион металла и координационные химические связи от воздействия молекул растворителя, но в кислой среде комплексы разрушаются мгновенно.
Прочность комплексов салициловой кислоты в слабощелочной среде резко возрастает у высокозарядных ионов металлов (Fe3+, Al3+, Ti4+, Sn4+ и т.д.). При комплексообразовании оксикислот ионизирует только фенольный гидроксил (-ОНÛО- + Н+), спиртовой вступает в координацию с ионом металла без отщепления протона.
С хлорным железом салициловая кислота образует фиолетовый комплекс не только в водном, но и в спиртовом растворе (в отличие от фенола), при добавлении минеральных кислот окраска исчезает:
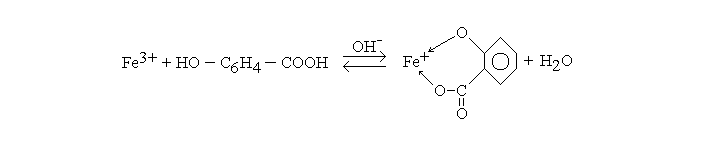
Рис. 2.9. Образование салицилат-ионом хелатного комплекса с железом.
Следует отметить, что салициловая кислота является хорошим осадителем четырехвалентных металлов: салициловая кислота является аналитическим реагентом на торий, так в слабо-кислой и нейтральной средах салицилат тория осаждается количественно [60]. В работе [60] авторами изучались твердые салицилаты Zr, Th и La, а также поведение комплексных салицилатов в щелочных средах. Таким образом, авторами установлено, что металлы осаждаются салициловой кислотой в виде соединений ZrO(SalI)2, ThO(SalI)2, La(SalI)3·1.5H2O. В щелочных средах цирконий и торий образуют комплексные ионы [ZrO(SalII)2]2- и [ThO(SalII)2]2-.
С цинком салициловая кислота образует соль следующего состава ZnO·Zn[C6H4(OH)COO]2·Н2О [61], которую получают при механохимичекком взаимодействии оксида цинка и салициловой кислоты.
Висмут образует с салицилат-ионом комплексное соединение , которому приписывают следующий состав [(C6H4(OH)COO)Bi+Bi2O3] [62], BiOC7H5O3 [63]. Ñîäåðæàíèå âèñìóòà ñîñòàâëÿåò 57.7%, ñàëèöèëàò-èîíà - 37.8%.
Способом получения основного салицилата висмута является метод, описанный в монографии Сингаловского [62]. Однако этот метод включает в себя многочисленные операции предварительной подготовки промежуточного продукта для твердофазного обмена с салициловой кислотой, состав и характеристики которого автор не указывает, а длительность синтеза составляет 72 часа.
Готовый продукт представляет собой белый, без запаха и вкуса порошок, не растворяющийся в воде и в спирте. При прокаливании он обугливается и оставляет после себя желтую окись висмута; при взбалтывании его в воде с раствором треххлористого железа жидкость окрашивается в фиолетовый цвет.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.