При значениях рН>2.4 в описанной выше системе протекает дальнейший гидролиз с образованием основных нитратов висмута, в которых молярное отношение нитрат-ионов к висмуту значительно меньше 1 [44, 45]. Так, в области значений рН 6.8-7.5 при обработке основного нитрата висмута состава [Bi6O5(OH)3](NO3)5·3H2O (IV) водными растворами аммака или гидроксида натрия образуется соединение состава [Bi6O6(OH)3](NO3)3·2H2O (V). При дальнейшем увеличении значений рН, в области 9.7-10.3 образуется основной нитрат висмута состава [Bi6O7(OH)2](NO3)2·H2O (VI), который при рН 12-14 переходит в оксид висмута [32].
Условия получения и состав основных нитратов висмута приведены в таблице 1.3.
2. Салициловая кислота
В качестве фармакопейных препаратов широкое применение получили соединения висмута с органическими кислотами, в том числе и с салициловой кислотой.
Салициловая кислота сильное дезинфицирующее средство. Многие ее производные являются лекарственными препаратами [50]. Салициловокислый натрий применяется как жаропонижающее и антиревматическое средство. Салол (крист. т.пл. 43ОС) применяется при кишечных заболеваниях и суставном ревматизме.
Наибольшее значение как лекарственное вещество имеет продукт ацетилирования фенольного гидроксила салициловой кислоты действием хлористого ацетила или уксусного ангидрида - ацетилсалициловая кислота, или аспирин. Аспирин (кристаллы кислого вкуса, т.пл. 135ОС) является одним из важнейших жаропонижающих, антиревматических средств.
Кроме медицинских целей, салициловая кислота употребляется в больших количествах для получения азокрасителей как вторая составляющая, а также для приготовления аминосалициловой кислоты, применяемой в качестве первой составляющей.
2.1. Общая характеристика
Салициловая кислота (рис. 2.1)- одна из наиболее распространенных оксибензойных кислот, соединений общей формулы НООСС6Н4-n(OH)n . Взаимное расположение карбоксильной и гидроксильных групп оказывает сильное влияние на кислотность и свойства оксибензойных кислот. В зависимости от положения группы ОН в таблице приведены некоторые свойства моногидроксибензойных кислот [51]
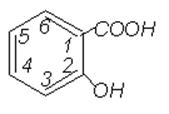 Рис. 2.1. Формула салициловой кислоты.
Рис. 2.1. Формула салициловой кислоты.
Таблица 2.1. Свойства моногидроксибензойных кислот (мол. м. 138.1)
|
Положение групп ОН |
Т. пл., оС |
d420 |
рК1 |
рК2 |
Р-римость в воде, % по массе (25оС) |
|
2 (орто-) |
159.5 |
1.443 |
2.7 |
7.5 |
1.80 |
|
3 (мета-) |
203 |
1.484 (25оС) |
4.1 |
9.9 |
1.07 |
|
4 (пара-) |
216.3 |
1.482 (25оС) |
4.6 |
9.3 |
0.49 (20оС) |
Так как электронные эффекты -ОН и -СООН-групп в бензольном ядре различны, то между ними возникает сильное электронное взаимодействие [52]. Поэтому в салициловой кислоте карбоксил стягивает электронную плотность в сторону СООН (электронный -I-эффект) и дезактивирует бензольное ядро в реакциях электрофильного замещения, тогда как фенольный гидроксил кроме слабого (в этой молекуле)- -I-эффекта проявляет сильный электронный +С-эффект, который компенсирует -I-эффект группы СООН (рис. 2.2.):
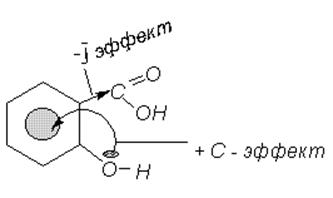
Рис. 2.2. Электронные эффекты -ОН и -СООН-групп салициловой кислоты.
Салициловая кислота образует кристаллы (т.пл. 159ОС) трудно растворимые в холодной воде [51]. Согласно [53], параметры кристаллической решетки о-НОС6Н4СООН: a 11.52, b 11.21, c 4.92A(±0.1%), b 90O50’±2’; пространственная группа Р21/a. Молекулы соединены попарно водородными связями О-Н...О в центросимметричные димеры. Кроме того, имеется внутримолекулярная водородная связь карбоксильной и гидроксильной группы (рис. 2.3.).
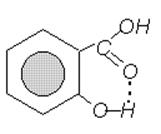
Рис. 2.3. Внутримолекулярная водородная связь в молекуле салициловой кислоты.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.