 Практический интерес к
изучению ЛХП вытекает из того, что, во-первых, это хорошая модель для изучения
различных химических реакций активных продуктов радиолиза, а во-вторых, как мы
уже обсуждали в курсе «методы …» измерение светосумм ЛЛ позволяет судить о
величине поглощенной объектом дозы (ЛЛД).
Практический интерес к
изучению ЛХП вытекает из того, что, во-первых, это хорошая модель для изучения
различных химических реакций активных продуктов радиолиза, а во-вторых, как мы
уже обсуждали в курсе «методы …» измерение светосумм ЛЛ позволяет судить о
величине поглощенной объектом дозы (ЛЛД).
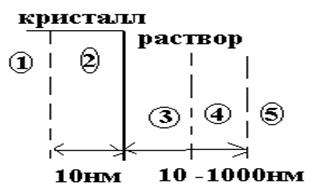
Рассматривая процессы, которые протекают при растворении облученного ТТ необходимо условно выделить несколько зон в лиосистеме.
1 –собственно кристалл
2 –область кристалла, в которой проявляется влияние растворителя
3 – растворитель, структура которого искажена влиянием кристалла
4 диффузионный пограничный слой
5 – исходный растворитель
Подобная модель работает как для органических, так и для неорганических облученных твердых тел.
В случае растворения облученных органических соединений, например углеводов, в первой зоне находятся СР, стабилизированные внутрикристаллическими водородными связями. В зоне 2 – кристаллическая решетка искажена влиянием растворителя и СР обретают некоторую конформационную подвижность. Здесь уже возможны внутрирадикальные перегруппировки, например реакция дегидратации гидроксиалкильных СР:
-СНОН-С*ОН- ----- -*СН-СО- + Н2О
Основной особенностью реакций, протекающих в третьей зоне является участие в них кислорода. Здесь начинается конкуренция реакций реакций рекомбинации СР и их окисления кислородом R + R·→ R2 R· + О2·→ RО2·
В четвертой зоне протекают разнообразные реакции перекисных СР – элиминирование гидроперекисных СР, рекомбинация перекисных СР, образование диалкил- и гидроперекисей : >СОО.ОН → >С=О + НО.2
RО2· + RH → ROOH + R· 2 НО.2 → Н2О2 + 'О2
RО2· + R· → ROOR При этом, по нашим данным, канал образования перекисных соединений является основным, поскольку для ряда облученных УВ и ПС РХВ этих соединений при дозах в несколько кГр даже превышал РХВ СР, содержащихся в кристаллах.
Очевидно, что количественный и качественный состав продуктов ЛХ реакций будет зависеть от таких факторов, как Д, рН растворителя, присутствия кислорода и скорости растворения. Последний фактор наиболее интересен, поскольку позволяет определять формально-кинетические параметры процесса образования конкретных продуктов.
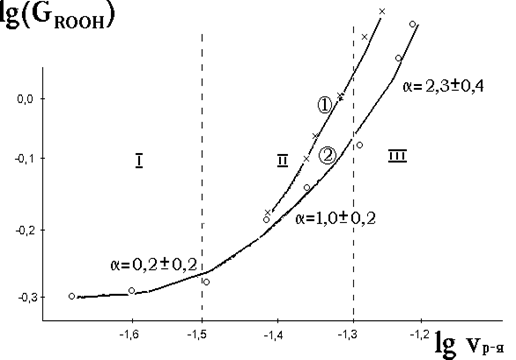
Сложный характер зависимости выхода перекисных соединений от скорости растворения облученных кристаллов лактозы (рис. 3.19) (формальный порядок реакции - α = 0,5¸2,3) указывает на то, что данный процесс является совокупностью ряда последовательно-параллельных реакций и в различных условиях растворения его лимитирующие стадии - различны. При малых скоростях растворения лимитирующей стадией последовательности реакций 3.21 - 3.30 является реакция 3.21, скорость которой определяется процессом обновления поверхности раздела фаз "облученный кристалл - растворитель, содержащий кислород" (α ~ 0). При значительных скоростях растворения (зона 111) определяющими стадиями в процессе образования перекисей, по-видимому, становятся реакции 3.25, 3.36 (α ~ 2), т.е. процесс лимитируется рекомбинациями перекисных СР.
В случае с облученным пентаэритритом, в процессе образования перекисей участвуют все три вида СР, присутствующих в кристаллах при комнатной температуре, однако с различной эффективностью /224/.
 Сопоставление
кинетических кривых образования перекисных соединений и кинетик содержания
различных СР в кристаллах (рис. 2,18, 3.8) позволило вывести уравнение,
описывающее зависимость количества образовавшихся молекул перекиси от
количества присутствующих в определенный момент времени СР каждого из трех
видов (формула 3.31 ).
Сопоставление
кинетических кривых образования перекисных соединений и кинетик содержания
различных СР в кристаллах (рис. 2,18, 3.8) позволило вывести уравнение,
описывающее зависимость количества образовавшихся молекул перекиси от
количества присутствующих в определенный момент времени СР каждого из трех
видов (формула 3.31 ).
Рисунок 3.19
Влияние скорости растворения в воде (метод вращающегося диска /186/) облученных таблеток из порошка лактозы (Д = 0,5 кГр) (2) и кристаллов ксилита (1) на РХВ перекисных (2) и карбонилсодержащих (1) молекулярных продуктов и формально-кинетический порядок реакции их образования (α).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.