Реакция, катализируемая ТРО, складывается из нескольких стадий:
Е (FeIII) + H2O2 → E (FeV)−0 + H2O,
E (FeV)−0 + I- → E (FeV)−0−I-,
E (FeV)−0−I- + H2O → E(FeIII) + HOI + OH-.
При этом перекись водорода окисляет простетическую группу ТРО − гем с образованием π-катионного радикала порфирина, который восстанавливается йодид-анионом, последний, окисляясь, образует гипойодит, электрофил, атакующий о-положение в остатке тирозина. В результате реакции образуется MIT. Второй цикл реакции заканчивается образованием DIT.
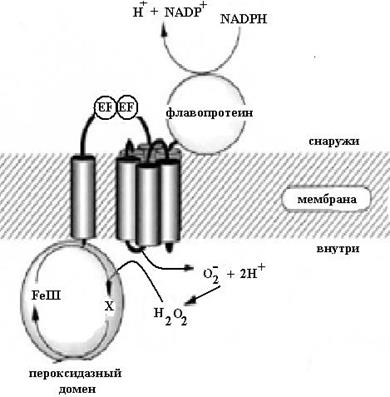
Рис. 6.34. Схематичное устройство тироидпероксидазы: внеклеточный NADPH-оксидазный домен, представляющий собой флавопротеин, две EF-структуры, семь мембранных участков, несущих два гема, и внутриклеточный пероксидазный домен, окисляющий неорганический йодид в катион йодиния, связанный с ТРО: Е-I+ (согласно Edens W.A., Sharling L., Cheng G., Shapira R., Kinkade J.M., Lee T., Edens H.A., Tang X., Sullards C., Flaherty D.B., Benian G.M., Lamb J.D. Tyrosine cross-linking of extracellular matrix is catalyzed by Duox, a multidomain oxidase/peroxidase with homology to the phagocyte oxidase subunit gp91phox // J. Cell Biol. 2001. Vol. 154. P. 879−891.)
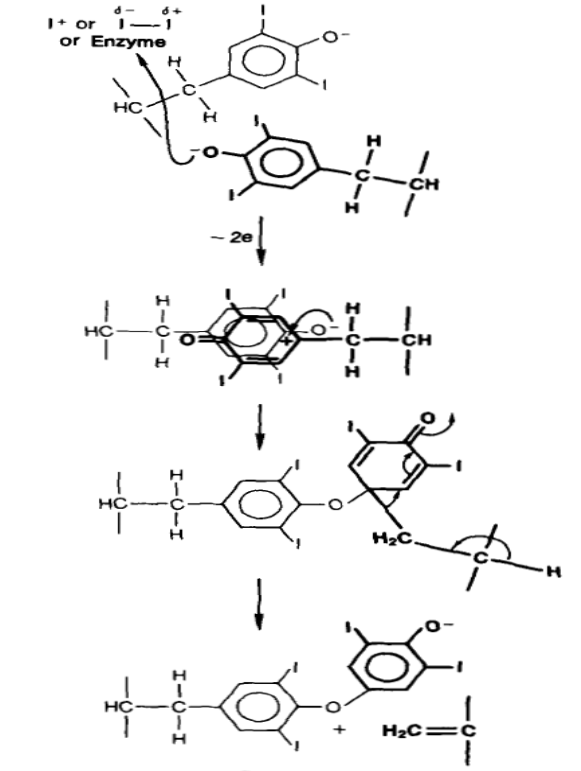
На схеме 60 приведен механизм реакции образования тироксина из двух остатков DIT в составе тиреоглобулина, при этом предполагают, что на этой стадии реакции окислителем выступает ион йодиния, связанный с ТРО. Один из остатков DIT, отдав два электрона комплексу Е-I+, образует тирозильный катион, атакующий гидроксильный анион второй молекулы DIT и после отщепления дегидроаланина приводящий к генерации молекулы тироксина.
В составе тиреоглобулина, состоящего приблизительно из 2750 аминокислотных остатков, около 130 остатков тирозина, каждый из которых потенциально может выступать центром образования прогормона, но практически только 25−40 остатков подвергаются йодированию и 4−16 йодированных остатков участвуют в реакции сопряжения.
 (60)
(60)
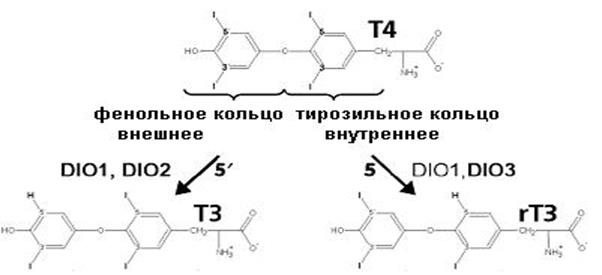
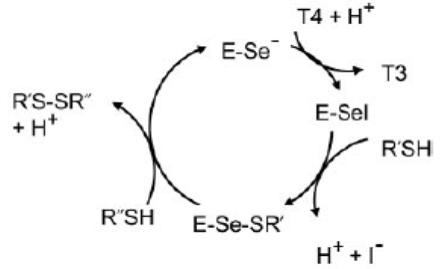
Образование Т3 или реверсивного Т3 (rТ3) путем отщепления йода из внешнего или внутреннего кольца Т4 катализируется селенсодержащим ферментом – дейодиназой (DIO) (схема 61), при этом промежуточным соединением является Е-Se-I, окисленный йодом остаток селеноцистеина в активном центре дейодиназы и восстанавливаемый (ди)тиольным соединением (RSH) с высвобождением йодид-аниона (схема 62). Дейодиназа участвует не только в активации тиреоидных гормонов, но и в их инактивации: дальнейшее дейодирование Т3 приводит к снятию воздействия гормона на организм.-
 (61)
(61)
Основной функцией тиреоидных гормонов является повышение поглощения кислорода большинством органов организма. Большая часть энергии, расходуемой клеткой, используется для работы Na+/K+-АТРазного насоса. Тиреоидные гормоны повышают эффективность этого насоса.
 (62)
(62)
Гормоны щитовидной железы − важные модуляторы процессов развития организмов. Они стимулируют процессы роста и клеточной дифференцировки, улучшают сократимость сердца, увеличивают скорость мышечных сокращений, ускоряют транскрипцию гена гормона роста, необходимы для правильного развития нервной системы плода.
Тиреоидные гормоны связываются с ядерными рецепторами клеток-мишеней в районе сайта TRE (участка узнавания тиреоидных гормонов) промоторной области ДНК и индуцируют синтез белков путем активации процессов транскрипции. Они могут связываться с ДНК как в виде гомодимеров, так и в виде гетеродимеров с ретиноидными рецепторами RXR, что происходит гораздо чаще (рис. 6.35).
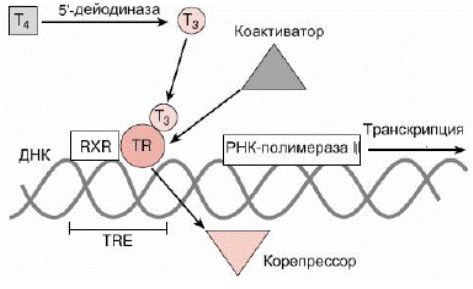
Рис. 6.35. Схема связывания рецептора тиреоидных гормонов с участком TRE промоторной области ДНК и активация процесса транскрипции зависимых генов
Гены, активируемые тиреоидными гормонами, кодируют следующие белки: синтетазу жирных кислот, фосфоенолпируват карбоксикиназу, липогенные ферменты, гормон роста, малик-энзим, тяжелую цепь миозина, белки-разобщители окислительного фосфорилирования, 5'-дейодиназу I типа.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.