Наиболее простой белок, содержащий два Са2+-связывающих центра, низкомолекулярный белок кишечника − кальбиндин участвует в сорбции кальция в тонком кишечнике и транспорте его в клетки и активируется витамином D. Более сложно устроены белки семейства S100. Для их активации необходима димеризация, хотя каждый мономер несет два Са2+-связывающих центра. Распространение и функции их разнообразны: регуляция активности многих ферментов, регуляция сборки и разборки элементов цитоскелета, участие в процессах экзо- и эндоцитоза и т. д.
Рис. 6.15. Пространственная стру-ктура кальмодулина, состоящего из тандема EF-hand доменов, связывающих четыре иона кальция (изображены серыми шариками), и центральной α-спирали (согласно Capozzi F., Casadei F., Luchinat C. EF-hand protein dynamics and evolution of calcium signal transducti- on: an NMR view // J. Biol. Inorg. Chem. 2006. Vol. 11. P. 949–962.)
Сайты связывания кальция в различных EF-hand доменах имеют к нему разное сродство. Так в кальмодулин-подобных белках С-концевой домен, называемый каноническим, обладает высоким сродством к иону кальция и насыщен им даже при низкой концентрации кальция в клетке (менее 10-7 М), N-концевой домен связывает ионы кальция только при повышении их концентрации в клетке (до 10-6−10-5 М). При связывании кальция спирали В и С тропонина С или любого другого представителя семейства кальмодулина становятся перпендикулярными центральной α-спирали. Опущенные вниз и идущие параллельно длинной центральной спирали белка спирали В и С означают, что белок свободен от ионов кальция. Поднятые вверх и ориентированные перпендикулярно длинной оси белка спирали В и С говорят о том, что Са2+-связывающий белок насыщен ионами кальция и что структура перешла из закрытой конформации в открытую (рис. 6.16). Насыщение кальцием регуляторных центров свидетельствует о поступлении в клетку сигнала, на который она должна реагировать.
В структуре белков-мишеней кальмодулина есть так называемые амфифильные α-спирали, одна сторона которых положительно заряжена из-за скопления основных аминокислотных остатков: лизина, аргинина − и охотно взаимодействует с водой, вторая половина, несущая гидрофобные аминокислотные остатки, старается спрятаться от воды и взаимодействует также с гидрофобными остатками. Изменив свою конформацию при связывании ионов кальция,
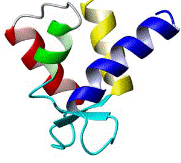
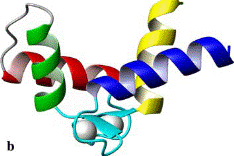
Рис. 6.16. Структура N-концевого домена мышечного тропонина С в отсутствие (слева − в закрытой конформации) и при связывании иона Са2+ (справа − в открытой конформации) (согласно Capozzi F., Casadei F., Luchinat C. EF-hand protein dynamics and evolution of calcium signal transduction: an NMR view // J. Biol. Inorg. Chem. 2006. Vol. 11. P. 949–962.)
кальмодулин открывает гидрофобные поверхности в области центральной α-спирали, ранее экранированные спиралями В и С. Эти области будут стремиться взаимодействовать с гидрофобной поверхностью амфифильной спирали белка-мишени. Особенно прочный контакт возникает, если гидрофобные участки центральной спирали кальмодулина изогнутся и обнимут амфифильную спираль белка-мишени (рис. 6.17).
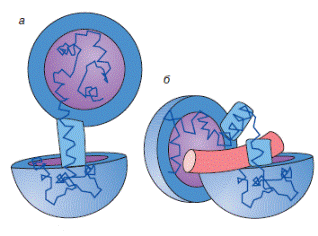
Рис. 6.17. Схема строения кальмодулина, насыщенного кальцием (а) и его комплекса с амфифильной спиралью белка-мишени (б). Полусферы изображают N- и С-концевые участки кальмодулина, соединенные жесткой и прямой α-спиралью. При взаимодействии с спиральным участком белка-мишени, изображенного на рисунке в виде цилиндра, центральная спираль кальмодулина «плавится», изгибается и ее гидрофобные области охватывают амфифильную область белка-мишени (согласно Гусев Н.Б. Внутриклеточные Са-связывающие белки. Часть 2. Структура и механизм функционирования // Соросовский образовательный журнал.1998. № 5. С. 10−16.)
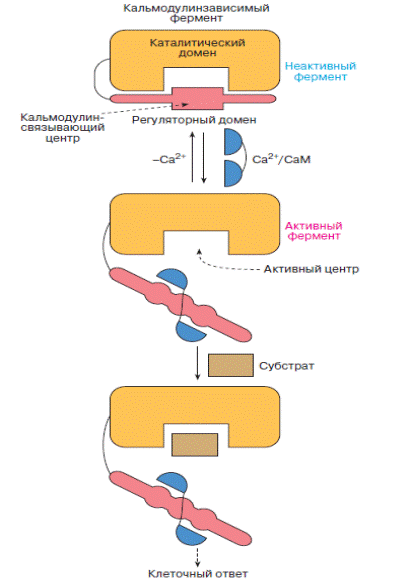
Конформация белка-мишени меняется, и он определенным способом активируется (в части 2. Биохимия движения это было рассмотрено на примере активации кальмодулином киназы легких цепей миозина (рис.6.18)).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.