Недостаток железа в организме является причиной возникновения железодефицитной анемии. Железодефицитная анемия развивается в результате длительного отрицательного баланса железа, когда снижается синтез гемоглобина.
6.1.8.2. Медь. Медь является важным микроэлементом для всех форм жизни. Этот переходный металл участвует в различных биологических процессах: в эмбриональном развитии, в транспорте кислорода у некоторых организмов (гемоцианин), в митохондриальной дыхательной цепи (цитохром с оксидаза), в метаболизме железа (церулоплазмин), детоксикации активных форм кислорода (супероксиддисмутаза), в биосинтезе нейротрансмиттеров (дофамингидроксилаза) и т. д.
В клетке медь встречается в двух степенях окисления: Cu2+ (окисленная форма) и Cu1+ (восстановленная форма). Таким образом, этот элемент участвует как кофактор в окислительно-восстановительных реакциях.
Попав в кровь после переноса через клеточную мембрану энтероцита (при этом ион Cu2+ восстанавливается в Cu1+ железосодержащей редуктазой), медь транспортируется в комплексе с альбумином, транскупреином, небольшими пептидами и даже отдельными аминокислотами, такими как гистидин, в печень, орган, где медь депонируется и подвергается различным превращениям. Из печени к клеткам организма медь доставляется альбумином или многофункциональным белком церулоплазмином. Депонирование меди осуществляет белок металлотионеин, треть которого представлено остатком цистеина (20), способного связать до семи ионов Cu1+.
Поскольку медь – переходный металл и легко вступает в окислительно-восстановительные реакции с образованием гидроксильного радикала, организм пытается защитить себя от токсического действия меди тем, что медь редко встречается в свободном виде, в основном в виде комплексов: купробелков, купротранспортеров или купрошаперонов. Например, для активации таких медьсодержащих ферментов как цитохром с оксидаза или Cu, Zn-супероксиддисмута-за (СОД) к месту их синтеза металл переносят купрошапероны (CCS, Аtox1, Cox17, НАН1). В нейронах и астроцитах медь переносится специфическими АТРазами. Перенос металла через клеточные мембраны у человека осуществляет купротранспортер hCtr1. На рис. 6.20 изображено поступление меди в клетку и использование этого иона на ее нужды.
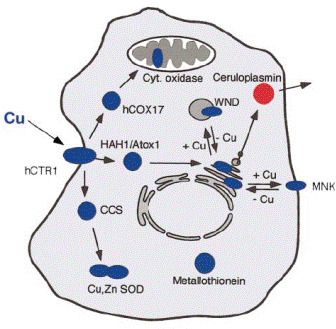
Рис. 6.20. Поступление иона меди в клетку с помощью транспортера hCtr1 и использование для синтеза цитохром с оксидазы с помощью купрошаперона Cox17, Cu, Zn-супероксиддисмутазы (СОД) с помощъю купрошаперона CCS; купрошаперон НАН1/Atox1 транспортирует медь в аппарат Гольджи для включение в секретируемые белки. WND и MNK – АТРазы, осуществляющие транспорт иона меди внутри клетки и через клеточную мембрану. К другим клеткам ион меди может доставлять и церулоплазмин. Депонирование меди в клетке осуществляет металлотионеин (согласно Pena M.M.O., Lee J., Thiele D.J. A delicate balance: homeostatic control of copper uptake and distribution// J. Nutr. 1999. Vol. 129. P. 1251–1260.)
На схеме 44 представлены реакции, которые катализируют медьсодержащие ферменты.
В белках медь встречается в комплексах нескольких видов (схемы 45 и 46):
1) моноядерного комплекса, имеющего или планарную конфигурацию (схема 46, а), или форму неправильного тетраэдра (схема 46, б), в вершинах которого располагаются остатки цистеинов, гистидинов и метионина, а медь в центре тетраэдра (такой центр связывания металла получил название место связывания иона меди I типа), встречается часто в так называемых синих белках (купредоксинах, азурине, пластоцианине), поскольку эти комплексы ярко-синего цвета, обусловленного переносом электрона от тиолатного остатка цистеина к иону Cu2+ (Cys− → Cu2+). Эти центры приспособлены к переносу одного электрона. На рис. 6.21 представлена пространственная структура азурина и место связывания иона меди I типа в этом белке.
купредоксин нитритредуктаза аскорбатоксидаза церулоплазмин,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.