Рис. 6.14. EF-hand белки содержат мотив спираль-петля-спираль. Петля, состоящая из 12−14 аминокислотных остатков, связывает ион Са2+. Название происходит от Е- и F-спиралей парвальбумина, в структуре которого впервые она была обнаружена, а расположение этих спиралей в белке было аналогично расположению большого и указательного пальцев в руке, отсюда слово «hand» (на рисунке слева). Минимальной структурной и функциональной единицей в EF-hand белках является димер EF-hand с линкером разной длины (справа) (согласно Capozzi F., Casadei F., Luchinat C. EF-hand protein dynamics and evolution of calcium signal transduction: an NMR view // J. Biol. Inorg. Chem. 2006. Vol. 11. P. 949–962.)
В петле ион кальция координируется 6−8 кислородсодержащими лигандами: карбоксильными группами аспартата или глутамата, карбонильными группами аспарагина или глутамина, спиртовыми группами серина или треонина, а также карбонильным атомом кислорода пептидной связи (−СО−NH−). Эти лиганды располагаются в 12-членной Са2+-связывающей петле в положениях 1, 3, 5, 7, 9 и 12 (схема 42)..
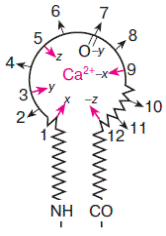
Классическая EF-hand петля (42)
|
1 |
3 |
5 |
6 |
7 |
9 |
12 |
|
D |
D |
D |
G, I, L |
T, F, K |
Н2О |
E |
Боковые радикалы аминокислотных остатков повернуты внутрь петли и принимают непосредственное участие в связывании иона кальция
Пространственно полипептидная петля образует почти правильный октаэдр, в вершинах X, Y, Z, -X, -Y, -Z которого располагаются 1, 3, 5, 7, 9 и 12 аминокислотные остатки петли соответственно. Кальций оказывается в центре октаэдра и удерживается в правильном положении взаимодействием с кислородными атомами лигандов, расположенных в вершинах октаэдра (схема 43).
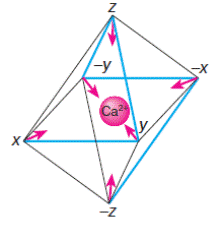 (43)
(43)
В положениях 8 и 10 обычно встречаются гидрофобные аминокислотные остатки, экранирующие расположенный в глубине октаэдра ион кальция от молекул воды. Остатки глицина, занимающие часто положения 4 и 6, придают спирали необходимую гибкость, особенно на первых стадиях дегидратация иона кальция. Таким образом, каждый из 12 аминокислотных остатков, входящих в петлю, или участвует в связывании иона кальция, или обеспечивает стабильность структуры полипептидной цепи. Поэтому, несмотря на многообразие, Са2+-связывающие петли Са2+-связывающих белков семейства EF-hand очень похожи между собой. В состав петли входит много отрицательно заряженных аминокислотных остатков, которые в отсутствие иона кальция отталкиваются и петля имеет рыхлый вид, в присутствии кальция петля принимает более компактную форму.
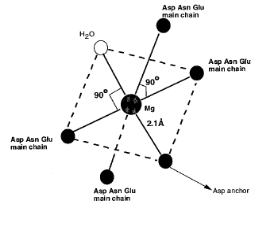
Ион кальция подобен иону магния, но отличается от него изменяющимся в зависимости от обстоятельств координационным числом (схема 42). Ион магния меньше по размерам (0,65 Ао), чем ион кальция (0,99 Ао), для его удержания в петле необходимо большее сближение отрицательно заряженных групп катионсвязывающей петли, что часто невозможно из-за электростатического отталкивания. Поэтому ион магния связывается с Са2+-связывающими белками с малым сродством.
Малые изменения в структуре катионсвязывающей петли при связывании Са2+ приводят к существенным изменениям в структуре всего белка. Это явление и лежит в основе способности Са2+-связывающих белков регулировать разные процессы, происходящие в клетке.
Одиночные Са2+-связывающие центры не обнаружены. Са2+-свя- зывающие участки образуют своеобразные пары. Минимальной структурной и функциональной единицей в Са2+-связывающих белках выступает димер EF-hand с линкером разной длины. Существуют белки с количеством EF-hand доменов от двух до шести. Наиболее представленное семейство Са2+-связывающих белков − кальмодулин-подобные белки содержат тандем EF-hand доменов и способны связать четыре иона кальция (рис.6.15).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.