Рис. 6.28. Влияние хрома на клеточный рецептор инсулина путем увеличения количества рецепторов и скорости их аутофосфорилирования
При дефиците хрома в организме могут возникнуть диабетоподобное состояние, атеросклероз и нарушение высшей нервной деятельности. Хром в своих высших степенях окисления токсичен, особенно соединения шестивалентного хрома, вызывающие аллергию, мутации и канцерогенез.
6.1.8.6. Молибден. Молибден поступает в организм в виде иона МоО42-. Этот переходный металл принимает участие в окислительно-восстановительных реакциях, изменяя свою степень окисления от +4 до +6. Значение молибдена для клетки определяется ферментными системами, в которых он принимает участие как кофактор, это нитратредуктаза, ксантин- (К.Ф. 1.1.1.204), альдегид- и сульфитоксидазы (К.Ф. 1.3.8.1). В п. 6.1.3.1 мы описали процесс азотфиксации, в котором ключевую роль играет нитрогеназа, содержащая Mo-Fe-белковый кофактор. Перечисленные выше ферменты являются гомодимерами и имеют в своем составе уникальные молибденовые коферменты (молибдоптерины, Мосо). Кроме них, эти ферменты содержат и другие простетические группы, а именно гем (типа цитохрома b5), FAD и комплексы негемового железа [2Fe-2S] (рис. 6.29).
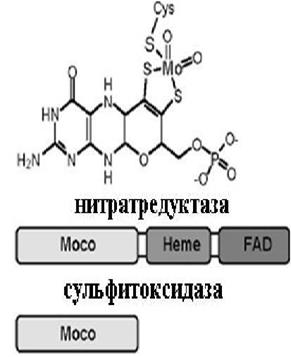
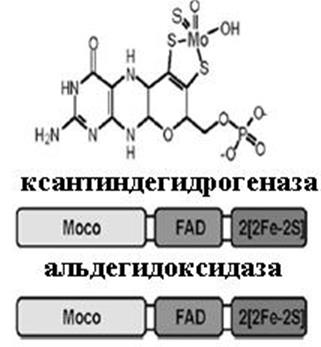
Рис. 6.29. Коферменты молибден-содержащих ферментов (молибдоптерины) и их схематичное строение
Сульфитоксидаза и нитратредуктаза входят в одно семейство, содержащее гемовый домен, который или получает электроны от Мосо домена (сульфитоксидаза), или передает свои электроны на Мосо домен (нитратредуктаза). Окисляя субстрат – сульфит, сульфитоксидаза передает электроны на цитохром с, для восстановления нитрата нитратредуктаза получает восстановительные эквиваленты от NADPH. Каталитический цикл первого фермента включает окисление сульфита, сопряженное с восстановлением молибдена, с последующими стадиями переноса электрона от цитохрома b5 к цитохрому с. В отличие от сульфитоксидазы нитратредуктаза содержит на С-конце FAD домен, в котором NADH или NADPH передают электроны и протоны для восстановления нитрат-иона.
Члены семейства ксантиноксидазы катализируют гидроксили-рование атома углерода (в альдегидах или ароматических гетероциклах), используя для внедрения в окисляемый субстрат атом кислорода воды. Эти ферменты молибдо-флавопротеины. Ксантиноксидаза, ключевой фермент процесса деградации пуринов, катализирует превращение гипоксантина в ксантин и далее в мочевую кислоту. Электроны, высвобожденные в ходе процесса гидроксилирования, передаются через железо-серные кластеры и FAD к молекулярному кислороду с образованием супероксидного аниона (ксантиноксидаза) или NAD+ (ксантиндегидрогеназа).
6.1.8.7. Цинк. Это переходный металл обладает заполненной d-оболочкой (d10), вследствие этого он не участвует в окислительно-восстановительных реакциях, что характерно для других переходных металлов.
Ион цинка, попадая в организм, транспортируется к клеткам в комплексе с белком-переносчиком металлотионеином. Поскольку с этим же белком образует комплекс и ион меди, то этим объясняется физиологический антагонизм меди и цинка.
Биологическая роль этого элемента в организме разнообразна. Прежде всего цинк является составной частью большого числа ферментов, участвующих в различных метаболических процессах синтеза и распада углеводов, жиров, белков, нуклеиновых кислот. Среди цинк-содержащих ферментов белки всех шести классов: гидролазы (карбоксипептидаза, щелочная фосфатаза, аминопептидаза, фосфолипаза С, АМР-деаминаза, неорганическая пирофосфатаза), лиазы (альдолаза, карбоангидраза, густин, коллагеназа), фосфотрансферазы (РНК- и ДНК-полимеразы, обратная транскриптаза, тимидинкиназа), оксидоредуктазы (алкогольдегидрогеназа, лактатдегидрогеназа, супероксиддисмутаза), лигазы (пируваткарбоксилаза), изомеразы.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.