Так как для регулярных растворов изменение объема и энтропии при смешении не происходит, то
![]()
Итак,
![]() (8.17)
(8.17)
Зная ![]() , можно найти
, можно найти ![]() и
и ![]() :
:
![]() ,
, ![]() (8.18)
(8.18)
Для активности и коэффициентов активности обоих компонентов получаем:
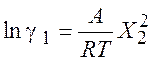 ,
, 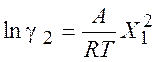 (8.19)
(8.19)
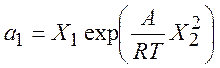 ,
, 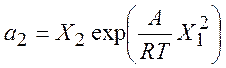 (8.20)
(8.20)
Энергия Гиббса смешения равна
![]() (8.21)
(8.21)
8.5. Осмотическое давление
Явление осмоса заключается в диффузии молекул растворителя через полупроницаемую мембрану, пропускающую только растворитель и разделяющую чистый растворитель и раствор (или растворы с различной концентрацией).
![]()
Если раствор близок к идеальному и мольная доля
растворенного вещества ![]() , то
, то
![]() (8.22)
(8.22)
Теперь можно поставить вопрос: какое
давление P следует приложить к раствору, чтобы
химический потенциал растворителя в растворе стал равен химическому потенциалу
чистого растворителя? Изменение ![]() под давлением
под давлением
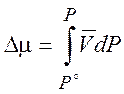 (8.23)
(8.23)
где ![]() -
парциальный мольный объем растворителя. Считая, что
-
парциальный мольный объем растворителя. Считая, что ![]() не
зависит от P, получаем
не
зависит от P, получаем
![]() (8.24)
(8.24)
где ![]() -
осмотическое давление. Уравнивая выражения (8.22) и (8.24), находим
-
осмотическое давление. Уравнивая выражения (8.22) и (8.24), находим
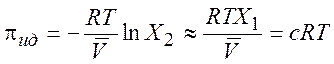 (8.25)
(8.25)
8.6. Химическое равновесие
Пусть в системе протекает химическая реакция
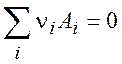
Тогда, в соответствии с общим условием равновесия
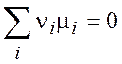
константа равновесия выражается через активности компонентов:
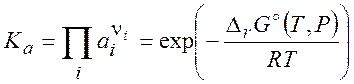 (8.26)
(8.26)
Глава 9. Термодинамика растворов электролитов
9.1. Формула Борна для энергии сольватации
Электролит – вещество, молекулы которого в растворе способны распадаться на ионы. Сольватация – процесс перехода иона из вакуума в раствор. Энергия сольватации – изменение энергии Гиббса в процессе сольватации.
Энергия образования иона в вакууме:
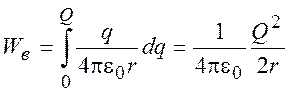 (9.1)
(9.1)
Энергия образования иона в растворе:
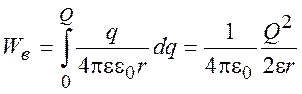 (9.2)
(9.2)
Следовательно, энергия сольватации
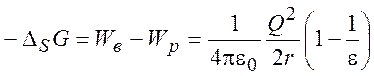 (9.3)
(9.3)
9.2. Уравнение Пуассона
Вычислим электростатический потенциал отдельного иона в зависимости от расстояния от его центра. Для нахождения усредненного потенциала необходимо решить сферически симметричное уравнение Пуассона:
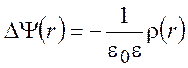 (9.4)
(9.4)
где ![]() -оператор Лапласа;
-оператор Лапласа; ![]() - электростатический потенциал;
- электростатический потенциал; ![]() - плонтость зарядов на расстоянии r от центрального иона. На расстоянии rот рассматриваемого иона концентрации
положительных
- плонтость зарядов на расстоянии r от центрального иона. На расстоянии rот рассматриваемого иона концентрации
положительных ![]() и отрицательных
и отрицательных ![]() ионов изменяются в соответствии с законом
Больцмана:
ионов изменяются в соответствии с законом
Больцмана:
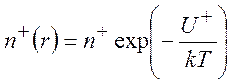 ,
, 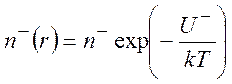 (9.5)
(9.5)
где
![]() ,
, ![]() (9.6)
(9.6)
Z – абсолютное значение заряда иона в единицах заряда
электрона; n+ и n- - средние
концентрации анионов и катионов. Если в растворе присутствуют ионы с разными
зарядами, то для ![]() получаем
получаем
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.