2.4. Энергия связи
Рассмотрим реакцию диссоциации молекулы AB (при некоторой температуре T):
![]()
При этом внутренняя энергия меняется на DT. Энергия связи A-B равна изменению внутренней энергии при диссоциации AB при T= 0:
![]() (V=
const, T= 0, идеальный газ)
(2.14)
(V=
const, T= 0, идеальный газ)
(2.14)
Обычно в эксперименте измеряется изменения энтальпии при некоторой температуре, например комнатной (25o C). Тогда можно вычислить D298 и D0 :
![]() (2.15)
(2.15)
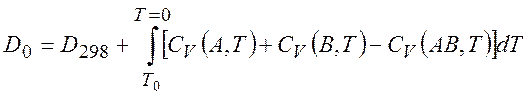 (2.16)
(2.16)
2.5. Закон Гесса
Если T= const, то тепловой эффект химической реакции при V= const или P= const не зависит от пути реакции (закон Гесса):
![]() (T = const)
(T = const)
![]() (T = const)
(T = const)
В ходе химической реакции
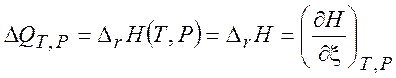
Обозначение для стандартных величин:
![]()
Располагая информацией о значениях стандартных энтальпий
образования (сгорания, растворения и т.д.) отдельных веществ, можно
рассчитывать изменение энтальпии ![]() в самых разнообразных
реакциях.
в самых разнообразных
реакциях.
Глава 3. Теория химического равновесия
3.1. Полезная работа химической реакции
Если термодинамическая
система снабжена специальным устройством, позволяющим получать полезную
работу ![]() (обратимую работу, которую можно
было бы использовать в дальнейшем для проведения процесса в обратном
направлении), то полная работа
(обратимую работу, которую можно
было бы использовать в дальнейшем для проведения процесса в обратном
направлении), то полная работа ![]() равна:
равна:
![]() (3.1)
(3.1)
В качестве полезной работы в химических системах чаще всего выступает электрическая работа. С учетом (3.1) первое начало термодинамики представим в виде
![]() (3.2)
(3.2)
Для описания необратимых процессов представим второе начало термодинамики в виде
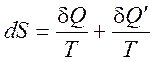 (3.3)
(3.3)
где величина ![]() -
некая фиктивная теплота (“некомпенсированная” теплота). Тогда из
уравнений (3.2) и (3.3) следует
-
некая фиктивная теплота (“некомпенсированная” теплота). Тогда из
уравнений (3.2) и (3.3) следует
![]() (3.4)
(3.4)
Из уравнения (3.4) найдем дифференциалы для всех термодинамических потенциалов:
![]() (3.5а)
(3.5а)
![]() (3.5б)
(3.5б)
![]() (3.5в)
(3.5в)
![]() (3.5г)
(3.5г)
Уравнения (3.5) позволяют описать термодинамику всех необратимых процессов в закрытых системах.
3.2. Направление самопроизвольного химического процесса. Условия равновесия
Рассмотрим термодинамические системы, в которых не производится полезная
работа (![]() = 0). Тогда из уравнений (3.5) имеем:
= 0). Тогда из уравнений (3.5) имеем:
![]() ,
, ![]() ,
,
![]() ,
, ![]() (направление
процесса).
(направление
процесса).
В состоянии равновесия:
![]() ,
, ![]() ,
, ![]() ,
, ![]() .
(3.6)
.
(3.6)
Наиболее часто, чтобы определить направление процесса в закрытых системах, используют энергию Гиббса (при T = const, P = const) .
Рассмотрим систему с одной химической реакцией. Изменения количеств
веществ будем описывать с помощью одной химической переменной ![]() . Начальные количества реагентов (ni0) будут
при этом параметрами. Тогда
. Начальные количества реагентов (ni0) будут
при этом параметрами. Тогда
![]() ,
, ![]() ,
, ![]() ,
, ![]() ,
,
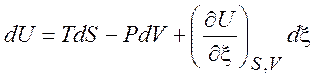 ,
, 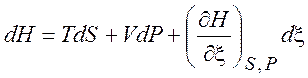 ,
,
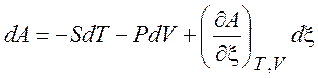 ,
, 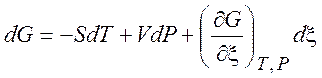 . (3.7)
. (3.7)
Из уравнений (3.7) следует, что если процесс проводится при постоянных значениях стандартных переменных, то
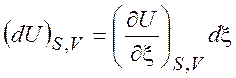 ,
, 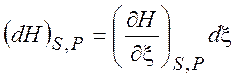 ,
,
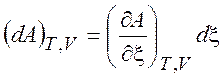 ,
, 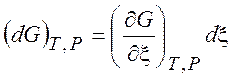 .
(3.8)
.
(3.8)
Таким образом,
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.