Переход i-го компонента из фазы ![]() в фазу
в фазу ![]() можно рассмотривать как химическую реакцию
можно рассмотривать как химическую реакцию
![]()
в равновесии:
![]()
поэтому
![]()
Аналогичные равенства химических потенциалов справедливы и для всех остальных фаз и компонентов. В итоге приходим к набору условий, которые должны выполняться при равновесии:
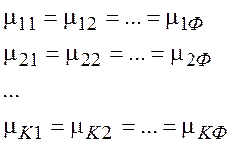 (6.2)
(6.2)
Общее число таких условий равно (Ф
- 1)K. С другой стороны, минимальное число
параметров, которое нужно знать, чтобы охарактеризовать гетерогенную систему
равно KФ + 2 – Ф (КФ - полное число переменных
Aij ; два дополнительных параметра –
это полное давление и температура; Ф - число условий на концентрации в
фазах, так как в любой фазе сумма мольных долей![]() ).
Поэтому вариантность гетерогенной системы (число степеней свободы) равна
).
Поэтому вариантность гетерогенной системы (число степеней свободы) равна
![]() (правило
фаз Гиббса) (6.3)
(правило
фаз Гиббса) (6.3)
Глава 7. Термодинамика смесей
7.1. Однородные функции
Функция называется однородной порядка m относительно переменных ni , если
![]() (7.1)
(7.1)
Для ![]() справедливо
справедливо
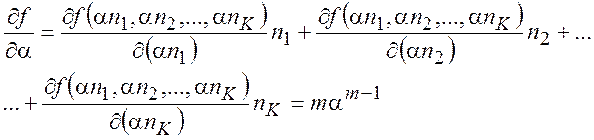 (7.2)
(7.2)
В термодинамике обычно встречаются
функции первого (экстенсивные) и нулевого порядка (интенсивные).К однородным
функциям первого порядка относятся G, V и др. Из уравнения (7.2) следует, что
для однородных функций первого порядка можно написать, полагая ![]()
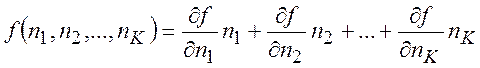 (7.3)
(7.3)
7.2. Уравнение Гиббса-Дюгема
Уравнения Гиббса-Дюгема
устанавливают связь между термодинамическими параметрами и составом смеси.
Рассмотрим для некоторой фазы орднородную функцию первого порядка относительно
переменных ni : ![]() . Это
может быть G, V и др. Для
. Это
может быть G, V и др. Для ![]() в общем случае можно
написать
в общем случае можно
написать
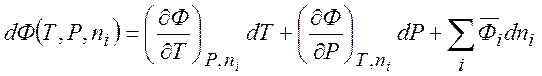 (7.4)
(7.4)
Учитывая, что функция ![]() однородна
однородна
![]()
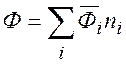
и
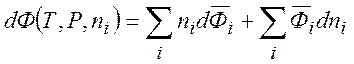 (7.5)
(7.5)
Получаем уравнение Гиббса-Дюгема:
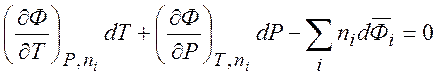 (7.6)
(7.6)
Например, для энергии Гиббса получаем
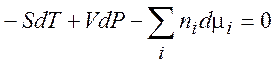 (7.7)
(7.7)
Уравнение Гиббса-Дюгема справедливо во всех случаях, независимо от того, находится система в равновесии или нет. На практике в качестве параметров удобно рассматривать мольные величины и мольные доли:
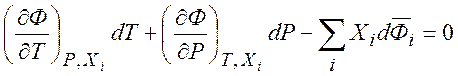 (7.8)
(7.8)
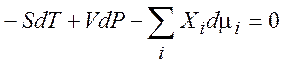 (7.9)
(7.9)
7.3. Функции смешения
Функция смешения ![]() равна разности мольной величины
равна разности мольной величины ![]() смеси и суммы величин
смеси и суммы величин ![]() , характеризующие чистые вещества, в
соответствии с их мольной долей
, характеризующие чистые вещества, в
соответствии с их мольной долей ![]() :
:
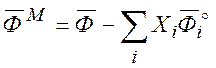 (7.10)
(7.10)
Например, функция смешения для энергии Гиббса
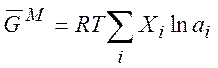 (7.11)
(7.11)
В идеальной смеси
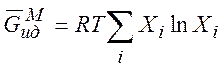 (7.12)
(7.12)
Найдем энтальпию смешения. Учитывая соотношение Гиббса-Гельмгольца
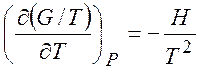
и, следовательно,
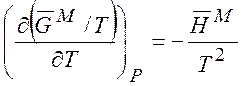
находим
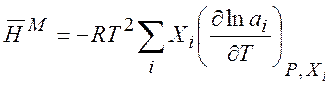 (7.13)
(7.13)
В идеальной смеси энтальпия смешения равна нулю:
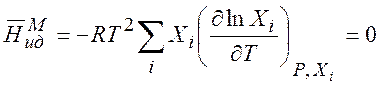 (7.14)
(7.14)
Найдем объем смешения. Объем одного моля смеси равен
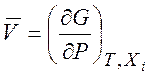
Поэтому
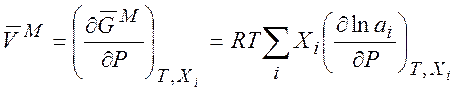 (7.15)
(7.15)
Найдем энтропию смешения. Учитывая, что
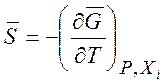
находим
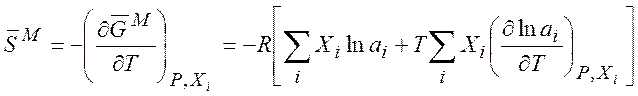 (7.16)
(7.16)
7.4. Избыточные функции
Избыточная функция - Разница между функцией смешения реальной системы и функцией смешения идеальной системы:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.