![]() (7.17)
(7.17)
Глава 8. Термодинамика растворов неэлектролитов
8.1. Классификация растворов
Общепринятая классификация на основе избыточных функций смешения:
1) идеальные растворы: ![]() ;
; ![]() ;
; ![]() ;
;
2) регулярные растворы: ![]() ;
; ![]() ;
; ![]() ;
;
3) атермальные растворы: ![]() ;
; ![]() ;
; ![]() ;
;
4) реальные растворы: ![]() ;
; ![]() ;
; ![]() .
.
Регулярныерастворы состоят из веществ, молекулы которых имеют близкие размеры; атермальные, наоборот, содержат молекулы с резко различающимися размерами (например, растворы полимерных молекул).
8.2. Давление пара над раствором. Закон Рауля
Рассмотрим раствор двух веществ, находящихся в равновесии с газовой фазой:
![]()
В общем случае для неидеального раствора:
![]() (8.1)
(8.1)
и
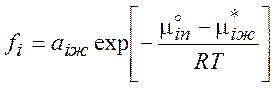 (8.2)
(8.2)
Для чистого вещества
![]() ,
,
![]()
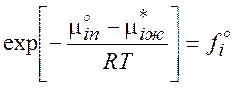 (8.3)
(8.3)
Следовательно, значение летучести над раствором определяет соотношение
![]() (8.4)
(8.4)
Вводя коэффициенты летучести и активности, получим
![]() (8.5)
(8.5)
Если газовая фаза идеальна, то
![]() (8.6)
(8.6)
Если обе фазы идеальны, то
![]() (закон
Рауля)
(8.7)
(закон
Рауля)
(8.7)
8.3. Растворимость газа в жидкости. Закон Генри
В равновесии для растворяющегося компонента выполняется равенство
![]()
Химический потенциал растворяемого газового компонента в рассматриваемых фазах:
![]() ,
, ![]()
Уравнивая химические потенциалы, получаем
![]() (8.8)
(8.8)
Отсюда
![]() (закон
Генри)
(8.9)
(закон
Генри)
(8.9)
где КГ – константа Генри:
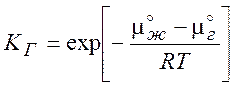 (8.10)
(8.10)
В идеальной системе концентрация растворенного газа в конденсированной фазе пропорциональна парциальному давлению газа над раствором:
![]() (8.11)
(8.11)
8.4. Регулярные растворы
Термодинамическое описание поведения регулярных растворов обычно основывается на квазикристаллической модели жидкости, в которой предполагается, что каждая молекула находится в одном из узлов квазикристаллической решетки. В случае двухкомпонентного раствора в каждом узле этой решетки можно с вероятностью X1 обнаружить молекулы первого типа, с вероятностью X2 – молекулы второго типа. Каждая молекула окружена несколькими (Z) соседями. Будем предполагать, что взаимодействие молекул в растворе ограничивается только взаимодействием с ближайшими соседями. Полная энергия взаимодействия молекул в одном моле раствора:
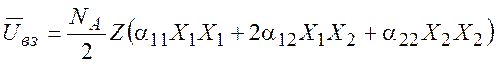 (8.12)
(8.12)
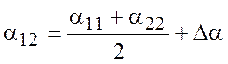 (8.13)
(8.13)
Тогда
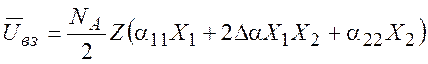 (8.14)
(8.14)
Энергия взаимодействия в исходных чистых веществах до смешения равна
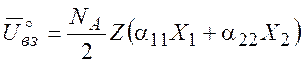 (8.15)
(8.15)
Следовательно, внутренняя энергия смешения равна
![]() (8.16)
(8.16)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.