![]()
Рис. 4.1. Диаграмма состояния водяного пара
Из p-v
диаграммы видно, что каждому давлению соответствует своя температура насыщения
(линия KC). Характер зависимости между
давлением насыщенного пара p![]() и температурой насыщения T
и температурой насыщения T![]() (кривая
насыщения) представлен на рис. 4.2.
(кривая
насыщения) представлен на рис. 4.2.
 p
p![]()
![]()
p![]() 2
2

![]()
![]() p
p![]()
![]()
![]()
![]()
p![]() 1
1
t![]() t
t![]() t
t![]()
![]() t
t![]()
![]()
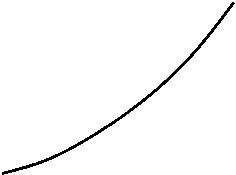
Рис. 4.2. Кривая насыщения
Каждому веществу соответствует своя кривая насыщения. Поскольку для насыщенного пара его давление и температура однозначно определяют друг друга, любой процесс, протекающий в двухфазной области, изображается
на p-v диаграмме линией, совпадающей с кривой насыщения.
Связь между термическими и калорическими величинами в процессе парообразования устанавливает уравнение Клапейрона – Клаузиуса:
![]()
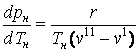 ,
(4.1)
,
(4.1)
где p![]() – давление насыщенных
паров, Па;
– давление насыщенных
паров, Па;
T![]() – абсолютная
температура насыщения, К;
– абсолютная
температура насыщения, К;
![]() – производная, взятая на кривой
фазового перехода;
– производная, взятая на кривой
фазового перехода;
r – скрытая теплота парообразования, Дж/кг;
v![]() – удельный объём
кипящей жидкости, м
– удельный объём
кипящей жидкости, м![]() /кг;
/кг;
v![]() – удельный объём сухого
насыщенного пара, м
– удельный объём сухого
насыщенного пара, м![]() /кг.
/кг.
Степень отклонения свойств насыщенного пара от идеально-газового состояния определяется отличием от единицы коэффициента сжимаемости водяного пара, определяемого по формуле:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.