Связь между ними выражается следующими зависимостями:
![]() ; (3.1)
; (3.1)
![]() (3.2)
(3.2)
Здесь 22,4 м![]() /
кмоль – объём киломоля газа при нормальных физических
/
кмоль – объём киломоля газа при нормальных физических
условиях ( T![]() = 273 K, B
= 273 K, B![]() = 760 мм рт.ст.);
= 760 мм рт.ст.);
v – удельный объём газа, м![]() ;
;
![]() – мольная масса газа, кг
/ кмоль.
– мольная масса газа, кг
/ кмоль.
Теплоемкость одного и того же газа не является величиной постоянной и зависит от количества газа, его температуры и от характера процесса.
В связи с зависимостью теплоемкости от температуры введены понятия истинная и средняя теплоемкости.
Если теплоемкость
определена в интервале температур от T![]() до T
до T![]() (величина нагрева газа в
эксперименте конечна), то она называется средней теплоемкостью в данном
интервале.
(величина нагрева газа в
эксперименте конечна), то она называется средней теплоемкостью в данном
интервале.
Например, для 1 кг газа
в изобарном процессе нагрева в интервале температур от T![]() до T
до T![]() средняя теплоемкость определяется
по формуле:
средняя теплоемкость определяется
по формуле:
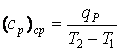 (3.3)
(3.3)
Истинная теплоемкость – это предел, κ которому стремится средняя теплоемкость при приближении интервала
температур T![]() –T
–T![]() к нулю:
к нулю:
 ,
(3.4)
,
(3.4)
где x – параметр, определяющий характер процесса.
Теплоемкость одноатомных газов не зависит от температуры и её можно считать постоянной величиной. Для двухатомных газов эта зависимость становится ощутимой только при высоких температурах (практически выше 500°С). Для трех- и многоатомных газов указанная зависимость очень существенна и может быть выражена математическим рядом:
![]() ,
, ![]() (3.5)
(3.5)
где a![]() , a
, a![]() , a
, a![]() – коэффициенты (постоянные для данного газа), которые
– коэффициенты (постоянные для данного газа), которые
приводятся в справочной литературе;
t– температура газа в ![]() С.
С.
Величина теплоемкости
различных газов зависит от атомного веса,
числа атомов в молекуле, пространственной структуры молекул и т.д.
Для идеальных газов, молекулы которых обладают только поступательными и вращательными степенями свободы, мольная теплоемкость в изохорном процессе может быть рассчитана на основе молекулярно-кинетической теории по формуле:
![]()
![]() ,
(3.6)
,
(3.6)
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.