+ 5. не проявляет кислотно-основных свойств при всех значениях рН.
310. Строение и свойства пептидной группы отражает следующая информация:
+ 1. пептидная связь гидролизуется как в кислой, так и в щелочной среде;
+ 2. вращение вокруг С-N-связи затруднено;
- 3. часть атомов находится в sp2 и часть в sp3-гибридизации;
+ 4. пептидная группа представляет собой трехцентровую рπ-сопряженную систему;
+ 5. все атомы находятся в состоянии sp2-гибридизации;
311. В первичной структуре пептидов и белков мономеры объединены связью:
- 1. дисульфидной;
- 2. водородной;
+ 3. пептидной;
- 4. ионной;
+ 5. амидной.
312. Условия полного гидролиза любых пептидов и белков вне организма:
- 1. щелочной гидролиз в запаянной ампуле;
- 2. кислотный гидролиз 24 часа в запаянной ампуле;
- 3. кислотный гидролиз с ~20% хлороводородной кислотой, Т = 100оС;
- 4. щелочной гидролиз, Т = 100оС в течение 2 часов;
+ 5. кислотном гидролизе, Т = 110оС с ~20% хлороводородной кислотой, в запаянной ампуле в течение 24 часа.
313. При полном кислотном гидролизе дипептида Ала-Гли в среде хлороводородной кислоты образуются.
- 1. 2-аминопропановая кислота;
- 2. 2-аминоэтановая кислота;
+ 3. аммониевый катион 2-аминопропановой кислоты;
+ 4. аммониевый катион 2-аминоэтановой кислоты;
- 5. оксониевый анион 2-аминопропановой кислоты.
314. Правильное название для трипептида:
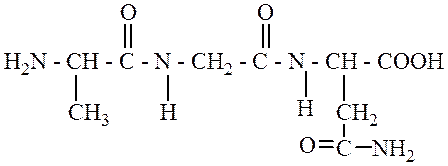
- 1. аланинглицинаспарагин;
- 2. аспарагилглицилаланин;
+ 3. аланилглициласпарагин;
- 4. аспарагинглицилаланин;
- 5. аланиласпарагилглицин.
315. Условия, соответствующие определению первичной структуры пептидов методом Эдмана.
- 1. отщепление и идентификация N-концевой a-аминокислоты в виде динитрофенил-производного;
+ 2. отщепление N-концевой a-аминокислоты в щелочной среде фенилизотиоцианатом;
- 3. отщепление a-аминокислоты с N-конца экзопептидазой;
- 4. отщепление a-аминокислоты с С-конца экзопептидазой;
- 5. частичный кислотный гидролиз.
316. Пептидную связь расщепляет пищеварительный фермент химотрипсин у дипептида.
+ 1. Фен-Ала;
- 2. Про-Ала;
+ 3. Тир-Ала;
+ 4. Три-Сер;
- 5. Мет-Ала.
317. Последовательность этапов, в стратегии синтеза дипептида.
+ 1. защита аминогруппы одной из a-аминокислот;
+ 2. защита карбоксильной группы a-аминокислоты, у которой не защищена аминогруппа.
+ 3. активация карбоксильной группы a-аминокислоты с защещенной a-аминогруппой;
+ 4. образование пептидной связи конденсацией;
+ 5. снятие всей защиты;
318. Реакция, используемая для защиты карбоксильной группы при искусственном синтезе пептидов:
+ 1. этерификация;
- 2. солеобразование;
- 3. ацилирование карбобензохлоридом;
- 4. кислотный гидролиз;
- 5. с тионилхлоридом.
320. Для защиты a-аминогруппы при искусственном синтезе пептидов используется реакция:
- 1. кислотного гидролиза;
- 2. солеобразования;
+ 3. ацилирования карбобензохлоридом;
- 4. этерификации этанолом;
- 5. алкилирования.
321. Изоэлектрическая точка трипептида Мет-Арг-Тир находится в среде:
- 1. кислой;
+ 2. основной;
- 3. слабокислой;
- 4. нейтральной;
- 5. нет ответа.
322. Изоэлектрическая точка трипептида Глу-Тре-Цис находится в среде:
- 1. основной;
- 2. нейтральной;
+ 3. кислой;
- 4. слабоосновной;
- 5. нет ответа.
323. У дипептида Сер-Арг в водном растворе среда:
- 1. нейтральная;
- 2. кислая;
+ 3. щелочная;
- 4. слабокислая.
324. Типы связей, которые фиксируют a-спираль пептидов и белков:
- 1. ионная;
+ 2. водородная;
- 3. гликозидная;
- 4. пептидная;
- 5. гидрофобное взаимодействие.
325. β-Структуру высокомолекулярных пептидов и белков фиксируют в пространстве связи:
- 1. пептидные;
- 2. дисульфидные;
- 3. ионные;
+ 4. водородные;
- 5. гидрофобное взаимодействие.
326. Третичную структуру высокомолекулярных пептидов и белков фиксируют в пространстве связи:
+ 1. ионные;
+ 2. дисульфидные;
+ 3. гидрофобное взаимодействие;
- 4. пептидные;
+ 5. водородные.
327. Качественная реакция на пептидную связь:
- 1. нингидриновая;
+ 2. биуретовая;
- 3. ксантопротеиновая;
- 4. с формальдегидом;
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.