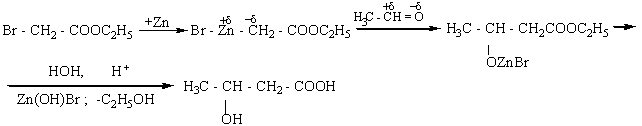 Восстановление
оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
Восстановление
оксокарбоновых кислот приводит к образованию гидроксикарбоновых кислот:
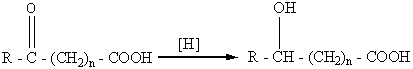 ,
,
где n =0, 1, 2, 3 и т.д., R = H, AIr, Ar.
Окисление спиртовой или альдегидной группы в карбоксильную используется обычно только для получения гидроксикислот, например:
![]()
этиленгликоль гликолевая кислота
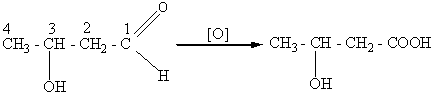
3 – гидроксибутаналь (альдоль) β – гидроксимасляная кислота.
Одноосновные гидроксикислоты с небольшой молекулярной массой это сиропообразные жидкости или твердые вещества (табл.1). Двухосновные гидроксикислоты – кристаллические вещества. Гидроксикислоты лучше растворяются в воде, чем соответствующие им карбоновые кислоты, но ограниченно растворяются в эфире и других органических растворителях. Гидроксикислоты имеют значительно более высокие температуры плавления и кипения, чем карбоновые кислоты с тем же самым количеством углеродных атомов. Многие гидрокислоты проявляют оптическую активность.
Гидрокислоты содержат две функциональные группы, и их химические свойства определяются присутствием как карбоксильной, так и гидроксильной групп. Поэтому гидроксикислоты одновременно проявляют свойства карбоновых кислот и спиртов. Причем карбоксильная и гироксильная группы могут участвовать в химических реакциях отдельно, независимо одна от другой, или обе вместе. Так, гидроксикислоты, как карбоновые кислоты, в водных растворах диссоциируют:

Однако гидроксикислоты, и в
первую очередь ![]() α –
гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им
карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой
(КD=1,38ּ10-4) кислот
приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления
кислотных свойств гидроксикислот являетя (–) I – эффект
спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ
– связей НО ← СН2 ← С ← О ← Н.
α –
гидроксикислоты, имеют более сильные кислотные свойства, чем соответствующие им
карбоновые кислоты. Например, константы диссоциации гликолевой (KD=1,48ּ10-4) и α – гидроксипропановой
(КD=1,38ּ10-4) кислот
приблизительно в 8 – 10 раз больше, чем соответственно уксусной (КD=1,75ּ10-5) и пропановой (КD=1,34ּ10-5) кислот. Причиной усиления
кислотных свойств гидроксикислот являетя (–) I – эффект
спиртовой ОН-группы, которая обуславливает смещение электронов по системе σ
– связей НО ← СН2 ← С ← О ← Н.
||
O
Поэтому атом водорода
карбоксильной группы легче протонизируется, чем в карбоновых кислотах, и сила
гидроксикислот увеличивается. Чем ближе спиртовый гидроксил расположен к
карбоксильной группе, тем сильнее будет гидроксикислота, поскольку по мере
удаления ОН-группы от СООН-группы влияние (–) I-эффекта
постепенно “затухает,,. Поэтому β-, γ -, δ -гидроксикислоты проявляют
значительно меньшую кислотность. Чем соответствующие им ![]() α –гидроксикислоты.
α –гидроксикислоты.
1. Кислотные свойства.
Гидроксикислоты, как и карбоновые кислоты. Образуют соли, сложные эфиры, амиды и т.д. Например:
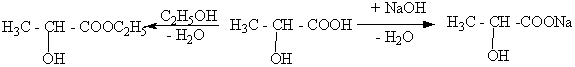
этиловый эфир молочная молочнокислый
молочной кислоты кислота натрий
(этиллактат) (лактат натрия)
2. Спиртовые свойства.
Гидроксикислоты, вступая в реакции как спирты. Образуют алкоголяты, простые эфиры, замещают гидроксил на галоген. Так, при взаимодействии гидроксикислот с щелочными металлами сначала образуются соли этих кислот. Которые далее реагируют с этими же веществами и образуют алкоголяты:
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.