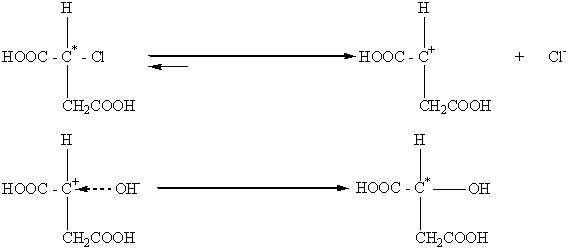
Таким образом, если в процессе химического взаимодействия наблюдается обращение конфигурации (изменение знака вращения), то можно сделать вывод, что эта реакция вероятно протекает по SN2-механизму. В тех случаях, когда нуклеофильные реакции замещения возле асимметрического атома С* протекает по мономолекулярному механизму (SN1), осуществляется рацемизация, которая сопровождается частичным вальденовским обращением. Реакции этого типа проходят через стадию предварительной диссоциации исходного вещества с образованием карбониевого иона, который имеет плоскую конфигурацию, и анион ОН- может его атаковать как справа, так и слева. Частичное вальденовское обращение объясняется тем, что карбониевый ион не успевает приобрести полностью плоскую конфигурацию.
В тех случаях, когда молекула содержит группу, которая препятствует карбониевому иону приобрести плоскую конфигурацию, например карбоксил, реакции SN1 осуществляются с сохранением конфигурации:
|
|
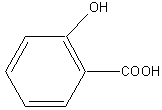
Из трех изомерных моногидроксибензойных кислот, относящихся к группе фенолокислот – наиболее важное значение имеет салициловая (орто-гидроксибензойная) кислота, которая встречается в некоторых растениях в виде гликозидов, например в коре вербы (от латинского слова salix- ,,верба” происходит название кислоты), в эфирных маслах цветов.
![]()
![]()
![]()
Салициловая кислота производится в промышленности методом прямого карбоксилирования фенола диоксидом углерода. Эта реакция открыта Г. Кольбе в 1859 г., усовершенствована в 1885 г. Р. Шмиттом и называется реакцией Кольбе-Шмитта. Диоксид углерода представляет собой слабый электрофильный реагент, поэтому для осуществления реакции необходимо усиление нуклеофильных свойств субстрата. В связи с этим реакцию проводят не с самим фенолом, а с его натриевой солью, так как феноксид-ион более сильный нуклеофил, чем фенол. Реакцию осуществляют в автоклавах при нагревании под давлением. Затем реакционную смесь подкисляют и выделяют салициловую кислоту. Реакция Кольбе-Шмитта осуществляется по механизму нуклеофильного замещения:
|
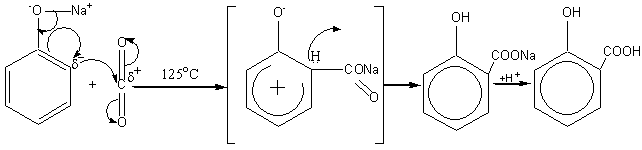
|
||||
|
фенолят натрия |
салициат натрия |
салициловая кислота |
||
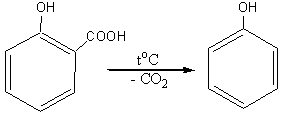
Салициловая кислота при нагревании легко декарбоксилируется с образованием фенола:
![]()
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.