Розв’язок:
1. М(сполуки) - ?
М(сполуки) = Dпов. М(пов) = 2,34. 29 = 67,0 г/моль
2. х : у -? ( ВхFу)
х : у =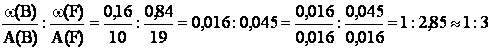 , тобто
елементарна формула сполуки - ВF3
, тобто
елементарна формула сполуки - ВF3
3. Молекулярна формула - ?
Молярна маса ВF3 = 10 + 19. 3 = 67 г/моль, тому формула ВF3 є молекулярною формулою
Відповідь: молекулярна формула сполуки ВF3.
ІV. Визначення маси, об’єму, кількості вихідних або кінцевих речовин
Приклад 5. Розрахуйте кількість речовини, масу і об’єм амоніаку, добутого в результаті нагрівання суміші 14 г азоту і 14 г водню.
Розв’язок:
1.n ( N2) - ?
n (N2) = m(N2) /M(N2) = 14 г : 28 г/моль = 0,5 моль
2. n (H2) - ?
n (H2) = m(H2) /M(H2) = 14 г : 2 г/моль = 7 моль
3.Яка речовина в надлишку - ?
Використовуючи рівняння, визначимо стехіометричне співвідношення кількостей реагуючих речовин:
N2 + 3H2 ® 2NH3
Співвідношення молей стехіометричне ( згідно з рівнянням реакції) складає:
n (N2) : n ( H2) = 1 : 3
співвідношення згідно з умовами складає:
n (N2) : n (H2) =0,5 : 7 = 1 : 14, кількість водню за умовами задачи у надлишку і кількість продукта реакції треба разраховувати, виходячі з кількості азоту.
4. n (NH3) - ?
n (NH3) = 2n (N2) = 0,5 . 2 = 1 моль
5. m ( NH3) - ? V(NH3) - ?
m (NH3) = n (NH3) . M(NH3) = 1 моль . 17 г/моль = 17 г
V(NH3) = n (NH3) . VM(NH3) = 1 моль . 22,4 л/моль = 22,4 л
Відповідь: кількість, маса і об’єм утворенного амоніаку складають відповідно: 1 моль, 17 г, 22,4 л.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.