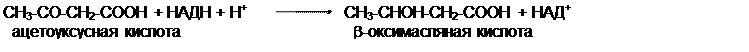 |
Ацетон образуется из ацетоуксусной кислоты при декарбоксилировании. Из печени поток кетоновых тел попадает во внепеченочные ткани.
 |
Обратите внимание: эти реакции происходят в митохондриях. В цитозоле имеются изоферменты - b-кетотиолазы и ГОМГ~КоА синтетазы, которые также катализируют образование ГОМГ~КоА, но в качестве промежуточного продукта в синтезе холестерола. Цитозольный и митохондриальный фонды ГОМГ~КоА не смешиваются.
Образование кетоновых тел в печени контролируется состоянием питания. Такое контрольное действие усиливается инсулином и глюкагоном. Принятие пищи и инсулин снижают образование кетоновых тел, в то время как при голодании стимулируется кетогенез вследствие увеличения количества жирных кислот в клетках. При голодании усиливается липолиз, растет уровень глюкагона
и концентрация цАМФ в печени. Происходит фосфорилирование, тем самым активация ГОМГ-КоА синтетазы. Аллостерическим ингибитором ГОМГ-КоА синтетазы выступает сукцинил-КоА.
В норме кетоновые тела являются источником энергии для мышц; при продолжительном голодании они могут использоваться центральной нервной системой. Следует иметь ввиду, что окисление кетоновых тел не может проходить в печени. В клетках других органов и тканей оно протекает в митохондриях. Такая избирательность обусловлена локализацией ферментов, катализирующих этот процесс.
Сначала b-гидроксибутират дегидрогеназа катализирует окисление b-гидроксибутирата до ацетоацетата в НАД+-зависимой реакции. Затем с помощью фермента, сукцинил~КоА :Ацетоацетил~КоА трансферазы, кофермент А перемещается с сукцинил~КоА на ацетоацетат. Образуется ацетоацетил~КоА, который является промежуточным продуктом последнего витка b-окисления жирных кислот. Этот фермент в печени не образуется. Именно поэтому там не может происходить окисление кетоновых тел. Зато спустя несколько суток после начала голодания в клетках мозга начинается экспрессия гена, кодирующего этот фермент. Тем самым мозг адаптируется к использованию кетоновых тел в качестве альтернативного источника энергии, снижая свою потребность в глюкозе и белке.
Тиолаза довершает расщепление ацетоацетил-КоА встраивая КоА по месту разрыва связи между a и b углеродными атомами. В результате образуется две молекулы ацетил-КоА.
Интенсивность окисления кетоновых тел во внепеченочных тканях пропорциональна их концентрации в крови. Общая концентрация кетоновых тел в крови обычно ниже 3 мг/100 мл, а средняя ежесуточная экскреция с мочой составляет приблизительно от 1 до 20 мг. В определенных метаболических условиях, когда происходит интенсивное окисление жирных кислот, в печени образуются значительные количества так называемых кетоновых тел.
Состояние организма, при котором концентрация кетоновых тел в крови выше нормальной, называется кетонемией. Повышенное содержание кетоновых тел в моче называется кетонурией. В тех случаях, когда имеет место выраженная кетонемия и кетонурия, в выдыхаемом воздухе ощущается запах ацетона. Он обусловлен спонтанным декарбоксилированием ацетоацетата в ацетон. Эти три симптома - кетонемия, кетонурия и запах ацетона при дыхании объединяются общим названием - кетоз.
Кетоз возникает в результате недостатка доступных углеводов. Например, при голодании их мало поступает (или не поступает) с пищей, а при сахарном диабете, вследствие недостатка гормона - инсулина, она не может эффективно окисляться в клетках органов и тканей. Это приводит к дисбалансу между этерификацией и липолизом в жировой ткани в сторону интенсификации последнего. В результате большое количество жирных кислот поступает в кровоток, а затем - в клетки. Эти кислоты являются главным субстратом для образования кетоновых тел в печени. Поскольку в результате их b-окисления образуется ацетил-КоА, естественно, что при увеличении количества окисляемых жирных кислот возрастает доля синтезируемых кетоновых тел.
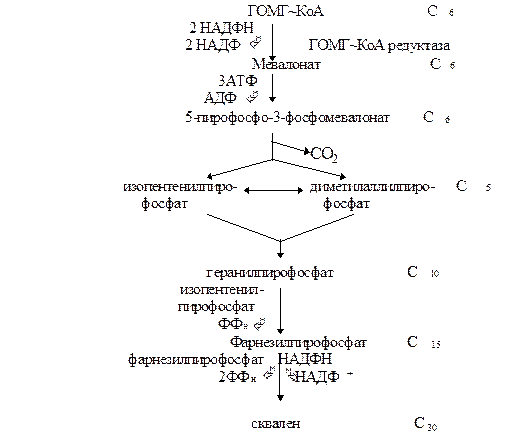
(ДПФ). Две изопреновые единицы конденсируются одна с другой и образуется промежуточное соединение с 10 “С”. Далее это соединение конденсируется ещё с одной изопреновой единицей и образуется продукт с 15 “С”. Наконец, два соединения С15 конденсируются друг с другом и образуется сквален.
 Образование С-С связей требует затраты энергии. Следует заметить, что
на превращение ГОМГ~КоА в активированную изопреновую единицу расходуется 3 моля
АТФ и 2 моля НАДФН. Активированная изопреновая единица содержит достаточно энергии для последующих реакций конденсации.
Образование С-С связей требует затраты энергии. Следует заметить, что
на превращение ГОМГ~КоА в активированную изопреновую единицу расходуется 3 моля
АТФ и 2 моля НАДФН. Активированная изопреновая единица содержит достаточно энергии для последующих реакций конденсации.
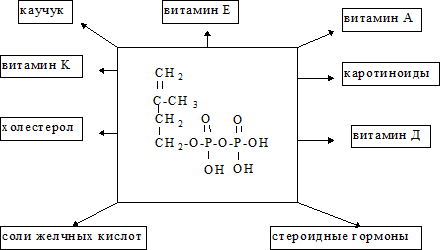
Регуляция синтеза холестерола. Синтез ГОМГ-КоА редуктазы тормозится конечным продуктом - холестеролом. С другой стороны, увеличение содержания холестерола в клетке активирует расщепление ГОМГ-КоА редуктазы. Инсулин усиливает, а глюкагон уменьшает активность этого фермента. Механизм гормональной регуляции заключается в фосфорилировании-дефосфорилировании молекулы ГОМГ-КоА редуктазы. Инсулин также усиливает синтез этого фермента. Нарушение регуляции биосинтеза холестерина - это один из факторов, влияющих на развитие атеросклероза. Некоторые лекарственные препараты, мевастатин, мевакор, ловастатин, которые используются для лечения атеросклероза, являются ингибиторами ГОМГ-КоА редуктазы. Биосинтез холестерина регулируется также концентрацией специфического белка-переносчика стеролов. Этот белок связывает нерастворимые в воде промежуточные продукты биосинтеза и таким образом делает их более доступными для последующих ферментативных реакций.
источников. Двумя основными видами ацетоновых тел являются ацетоацетат и b-гидроксибутират. b-гидроксибутират - это восстановленная форма ацетоацетата. Ацетоацетат образуется в клетках печени из ацетил~КоА. Образование происходит в
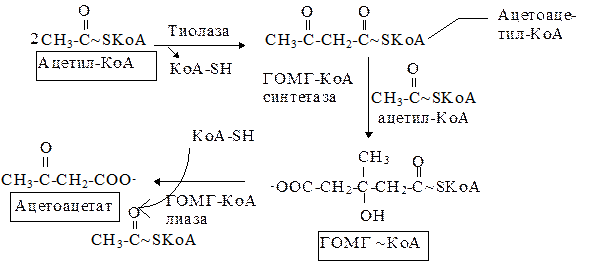
митохондриальном матриксе.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.