При применении для этого процесса Pt-катализатора нет необходимости в дополнительном нагревании, так как катализатор разогревается за счет теплоты реакции и сохраняет это тепло во все время протекания процесса; медные же катализаторы приходится предварительно разогревать. Е. И. Орлов разрешил этот вопрос применением так называемого контактного запала из платинированного асбеста, который помещают перед медным контактом. При пропускании метаноло – воздушной смеси запал накаливается и, сообщая теплоту Cu-контакту, нагревает его до температуры, нужной для проведения реакции. Запал предотвращает также и затухание реакции, которое может произойти при изменении режима работы.
Катализатором обычно служит медная сетка, которая при реакции разогревается до 550—600° (темно-красное каление). В медных трубах, наполненных катализатором, из смеси воздух—метанол (3 : 1 или 3 : 2) получают из 600 кг метанола до 120 кг формальдегида в виде 40% водного раствора (формалин). Стабилизация формальдегида достигается присутствием некоторого количества метанола. Длительность жизни медного катализатора зависит от режима работы, чистоты меди и применяемого метанола. Особенно вредны примеси свинца к меди и ацетона или карбонила железа к метанолу, что резко снижает выход формальдегида.
Глиоксаль - является активным химическим веществом, близким по свойствам к формальдегиду, но менее токсичным и превосходящим формальдегид по реакционной способности. Поэтому в качестве аналога производства глиоксаля были взяты технологические схемы производства формальдегида.
1.4.1 Производство формальдегида на серебряном катализаторе
Основной производственный метод получения формальдегида во всем мире уже много лет – каталитическое взаимодействие метанола с кислородом воздуха.
В 20-х годах многими исследователями было показано, что серебро и его сплавы более эффективны в качестве катализаторов, чем медь.
Как известно, смеси метанола с кислородом или воздухом взрывоопасны. При атмосферном давлении область распространения пламени в смесях метанол – воздух находится в диапазоне объемного содержания метанола от 6,7 до 36,4 %. При добавлении инертного газа (азот) пределы взрывных концентраций сужаются, также аналогичный эффект оказывает добавление паров воды (рисунок 1.1). С повышением температуры указанные пределы несколько расширяются.

Рисунок 1.1 – Влияние воды на размеры области распространения пламени в смесях метанола с воздухом
Окислительная конверсия метанола на серебре (рисунок 1.2) проводится при соотношении метанол : воздух выше верхнего предела взрывной концентрации, то есть при большом избытке метанола по отношению к кислороду.
Образование формальдегида осуществляется в результате протекания параллельных реакций простого и окислительного дегидрирования метанола (тепловые эффекты найдены на основе данных [17, стр. 33], ∆Q298 = - ∆Н298 ):
СН3ОН + 0,5О2 → СН2О + Н2О + 147,4 кДж/моль, (1.4.1)
СН3ОН → СН2О + Н2 – 93,4 кДж/моль. (1.4.2)
Наряду с этими реакциями в системе протекает ряд побочных превращений:
СН3ОН + 3/2О2 → СО2 + 2Н2О + 575,1 кДж/моль, (1.4.3)
СН2О + 0,5О2 → НСООН + 270,4 кДж/мол, (1.4.4)
НСООН + 0,5О2 → СО2 + Н2О + 14,5 кДж/моль, (1.4.5)
СН2О → СО +Н2 + 1,9 кДж/моль. (1.4.6)
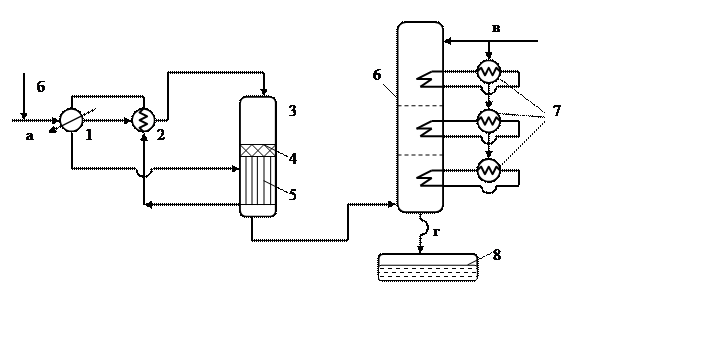 |
Рисунок 1.2 – Технологическая схема производства формальдегида на серебряном катализаторе
1 – испаритель; 2 ,7– теплообменник; 3 – реактор; 4 – катализатор; 5 – подконтактный холодильник; 6 – абсорбер; 8 – сборник формалина; а –воздух, б – метанол, в – вода, г – метанольный формалин.
Технологическая схема рассматриваемого процесса приведена на рисунке 1.2. Она состоит из следующих узлов: Испарителя 1; четырех теплообменников 2 и 7; реактора 3, в который входят катализатор 4 и подконтактный холодильник 5; абсорбера 6; сборника формалина 8.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.