

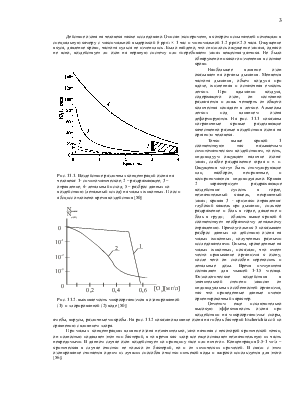





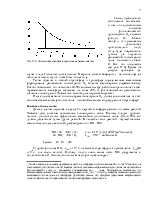





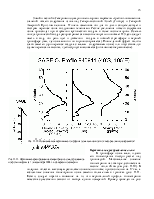

























Озон (О3) – аллотропная модификация кислорода, которая может существовать в трех агрегатных состояниях. Озон нестабильное соединение и даже при комнатной температуре медленно разлагается на молекулярный кислород. С точки зрения теоретической химии он должен считаться радикалом, поскольку образуется при взаимодействии стабильной молекулы кислорода с атомом, валентность которого не должна изменяться. В условиях реальной атмосферы озон образуется и уничтожается во всей толще, однако концентрации его в различных слоях существенно различаются.
Озон в переводе с греческого – «пахну». Ученые обратили внимание на озон в конце ХVIII века, а к началу XIX была установлена его химическая формула[1]. Озон получил достаточно широкое применение в человеческой деятельности [50,56,57].
В химии:
- как сильный, универсальный окислитель;
- как основной источник образования уникального атома О(1D) (возбужденное состояние атомарного
кислорода), участвующего во многих реакциях.
В химической технологии:
- в очистных комплексах химических производств;
- при дезинфекции и осветлении воды;
- при устранении запахов;
- при извлечении золота и серебра из руд.
В биологии:
- как вещество, воздействующее на микроорганизмы.
В физике и физической химии:
- при создании полупроводников, жидких кристаллов, сверхпроводников, ферромагнитных пленок.
В медицине:
- при заживлении ран, лечении заболеваний крови, органов зрения, дыхания;
- при хранении контактных линз и стерилизации медицинских инструментов.
В быту:
- для создания комфортной атмосферы в помещениях и их дезинфекции.
В сельскохозяйственном производстве:
- при хранении продуктов, устранении пестицидов и т д.
Однако самым важным является то, что атмосферный озон поглощает ультрафиолетовое излучение Солнца, вредное для живых клеток. В 1920 году было оценено общее содержание озона в атмосфере и определена высота его максимальной концентрации[2]. Первая конференция по атмосферному озону состоялось в 1929 году в Париже, вторая – в1936 году в Оксфорде. Регулярный мониторинг общего содержания озона начат на обсерватории Ароза в Швейцарии с1926 года.
Исчезновение озонового слоя или хотя бы его существенное уменьшение могли бы привести к неблагоприятным последствиям для всего живого на Земле. В последние 30 лет тенденция к истощению слоя озона в атмосфере несомненно видна. Считается, что основной причиной являются выбросы промышленных веществ в атмосферу.
Озон при нормальных условиях – газ с резким запахом. При очень низких концентрациях запах ощущается как приятная свежесть, но с увеличением концентрации становится неприятным. К нему легко привыкнуть. При концентрациях порядка 10 ПДК[3] озон ощущается очень хорошо, но через несколько минут ощущение пропадает практически полностью. Это необходимо иметь в виду при работе с озоном, так как он – вредное вещество.
При концентрациях 15–20 % газообразный озон имеет голубой цвет. При атмосферном давлении и температуре 161.3 оК он превращается в жидкость темно-синего цвета. Затвердевает при температуре 80.6 оК. Твердый озон - вещество темно-фиолетового цвета. При концентрации выше 20% газообразный озон может превращаться в кислород взрывным образом. То же относится к жидкому и твердому озону. Инициаторами могут быть: термический нагрев, ультрафиолетовое или инфракрасное лазерное излучение, органические примеси, катализаторы и т.п.
Озон легко создается в электрическом разряде в результате диссоциации молекулы кислорода при столкновении с электронами c энергией, превышающей 5.16 эВ, или под действием излучений с длиной волны, меньшей 240 нм (в том числе всех видов ионизирующих излучений). Затрачиваемая энергия уходит на диссоциацию кислорода, а сама реакция образования озона идет с выделением теплоты. Чтобы отвести избыток энергии, в реакции должна участвовать буферная частица. Часть избытка энергии – 2.2 эВ - передается буферной частице, оставшаяся часть (2.96 эВ на две молекулы озона) увеличивает внутреннюю энергию молекулы озона относительно молекулярного кислорода. Считается, что этот избыток энергии определяет уникальные химические и биологические «способности» озона.
Озон – один из самых сильных окислителей. Обладая значительным избытком внутренней энергии, озон, приблизившись к молекуле (или атому), с которым предстоит взаимодействовать, легко «отдает» атом кислорода. При этом создается до 29 различных видов возбужденных молекул и атомов кислорода, каждый из которых впоследствии также может взаимодействовать с реагентом. Поэтому константа реакции, определяемая экспериментально, характеризует на самом деле целое множество различных реакций. Особенно активны некоторые формы атомарного кислорода. Как результат, ход реакций с озоном сильно зависит от температуры, концентрации, наличия примесей и т.п. (см. ниже).
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.