Смысл
приведенного соотношения заключается в том, что единственным способом фотохимического
производства О3 является фотолиз О2. Можно ожидать, что
равновесие установится приблизительно тогда, когда будет «наработано» нужное
для получения равновесной концентрации озона количество атомов О. Вот, что
получается (см. рис. 11.6). Кривая на рисунке приведена для случая, когда
Солнце находится в зе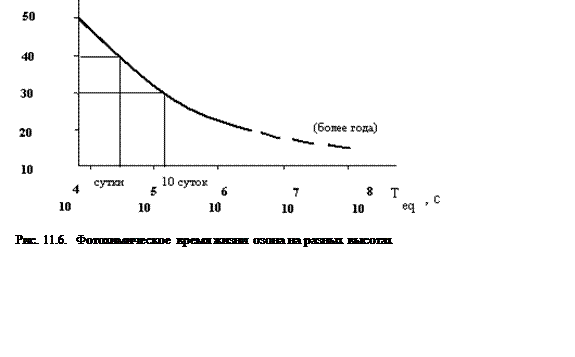 ните. В верхних слоях атмосферы τeq
– величина порядка нескольких часов и суток, ниже 15км - более года.
ните. В верхних слоях атмосферы τeq
– величина порядка нескольких часов и суток, ниже 15км - более года.
Таким образом, в нижней стратосфере и тропосфере определяющим механизмом формирования равновесной концентрации O3 является массоперенос (перемешивание). Оценки показывают, что на высотах 30-80 км изменение средней концентрации озона за счет перемешивания атмосферы составляет не более 20% от фотохимического равновесного значения концентрации. На меньших высотах роль переноса возрастает.
И еще одно замечание: в ночное время концентрация O3 должна увеличиваться, так как выключается механизм фотолиза озона – основной механизм его разрушения в стратосфере.
Влияние окислов азота
Даже с учетом переноса в средней и верхней атмосфере расчеты по схеме реакций Чепмена дают слишком завышенные концентрации озона. Поэтому следует признать наличие дополнительных эффективных механизмов уничтожения озона. Около 80% его должно разлагаться путем других реакций. В качестве таких реакций[6], осуществляющих каталитическое разложение О3, рассмотрим цикл NO – NO2:
NO + O3 → NO2 + O2, kNO2=3∙10-12 exp(-1500/T) см3/(молек∙с),
O + NO2 → NO + O2, kNO = 9∙10-12 см3/(молек∙с),
¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯¯
Сумма: О + О3 → 2О2.
Скорость фотолиза NO2 JNO2 = 10-2 с-1 на высотах стратосферы, а произведение kNO[О] =10-4 с-1 (не очень велико). Поэтому только очень малая часть NO2 разрушается в столкновениях с О. Значительно большая часть фотодиссоциирует:
NO2 + hν → NO + O, JNO2
и, c одной стороны, ведет к регенерации озона:
O+O2+М → O3+М, kО3,
с другой стороны, образовавшаяся молекула NO разрушает одну молекулу О3. Следовательно, именно реакция образования NО в процессе столкновений NО2+О является стадией, определяющей скорость разрушения озона, поскольку фотодиссоциация NO2 не приводит к изменению концентрации O3.
Для стационарных концентраций NO и NO2 имеем
а) Баланс NO2 :
kNO2[O3][NO] = JNO2 [NO2] + kNO[O][NO2]
(просто приравнять нулю скорость изменения d[NO]/dt.
Скорость изменения [O3] теперь будет
б) Баланс О3:
d[O3]/dt = kО3[O][O2][M] - JО3 [O3] - kО2[O][O3] - kNO[NO][O3].
Считая, как и ранее, концентрацию O стационарной (условие фотохимического равновесия), можем записать
в) Баланс О:
JNO2 [NO2] + JО2 [O2] + JО3 [O3] = kО3[O][O2][M] + kО2[O][O3] + kNO[O][NO2].
Здесь левая часть – фотолитическое производство О, правая – расход О в реакциях. Это следует из уравнения для скорости изменения [O]. Тогда для d[O3]/dt находим с учетом последних трех соотношений
d[O3]/dt = 0 = 2JО2 [O2] - 2kО2[O][O3] - 2kNO[O][NO2].
Здесь выражение для JО3[O3] взято из пункта (в), после чего выражение для JNO2[NO2] подставлено из пункта (а).
На высоте h=20 км kNO/kО2 = 16600, а [O3]/[NO2] ≈ 1000. Следовательно, член kNO[O][NO2] более чем в 10 раз превышает kО2[O][O3], если воспользоваться оценками для концентраций [O], [NO2], [O3]. Таким образом, в атмосфере, содержащей NO2, разрушение озона идет с существенно большей эффективностью. Достаточно приблизительно 0,01% NO2 от концентрации озона, чтобы эффективность каталитического разрушения O3 была сравнима со скоростью реакции О + О3 → 2О2.
 Удаление NO2
из атмосферы
Удаление NO2
из атмосферы
NO2 частично удаляется из атмосферы за счет взаимодействия с ОН и образования азотной кислоты:
NO2 + ОН + М → HNO3+М.
Часть азотной кислоты диффундирует в тропосферу и вымывается оттуда с дождями. Оставшаяся часть снова превращается в NO2 при фотолизе:
HNO3 + hν → ОН + NO2.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.