1) м-РНК при содействии фактора IF3 своим 5'-концом взаимодействует с м-РНК-связывающим центром маленькой свободной субъединицы благодаря специфичности инициирующего кодона АУГ (механизм отличается у про- и эукариот);
2) по принципу комплементарности своего антикодона формилметионин-т-РНК взаимодействует с АУГ-кодоном м-РНК и связывается в Р-центре при содействии фактора инициации IF2;
3) большая субъединица связывается с малой.
Всему этому процессу способствуют белковые факторы инициации.
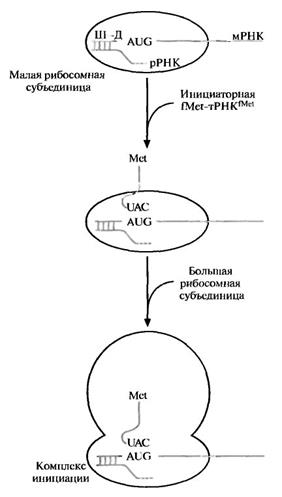
Рис. 4.2 Инициация трансляции в прокариотической клетке
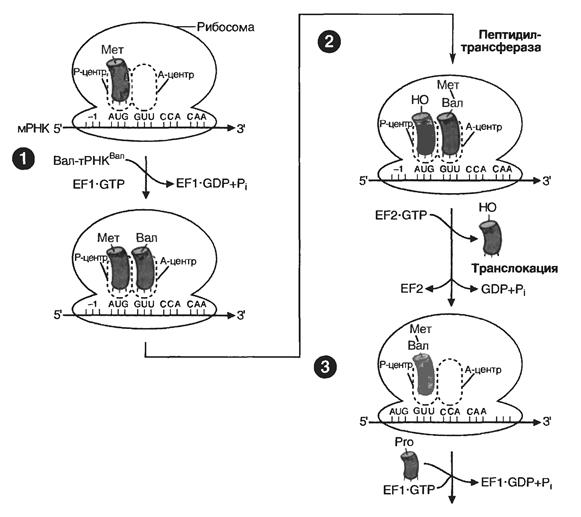
Процесс элонгации начинается с образования первой пептидной связи и заканчивается образованием последней пептидной связи (Рис. 4.3). Этому способствуют белковые трансферные факторы G и Т (Tu и Ts).
1. Вторая (или любая очередная) аа-т-РНК в комплексе с Tu-фактором и ГТФ поступает в А-центр, где может связаться в случае комплементарности своего антикодона кодону м-РНК.
2. Образование пептидной связи между аминогруппой аминокислоты из А-центра и карбоксильной группой аминокислоты из Р-центра с помощью ферментов пептидилтрансфераз.
3. Расщепление ГТФ и транслокация (невозможная без G фактора), т. е. продвижение м-РНК на один триплет, перескакивание т-РНК из А в Р-центр и вытеснение при этом из Р-центра предшествующей т-РНК. В итоге А-центр свободен и готов к связыванию нового аа-т-РНК, и так до встречи одного из стоп-кодонов, вызывающих терминацию.
Трем стоп-кодонам (УАГ, УАА, УГА) не соответствует никакой т-РНК, поэтому в случае появления такого кодона синтез белка прекращается, и молекула полипептида остается привязанной последней аминокислотой через т-РНК в Р-центре.
Существуют факторы терминации TF1 (узнает кодоны УАГ, УАА) и TF2 (узнает кодоны УАА, УГА), которые поступают в А-центр, узнавая терминирующие кодоны, и включают эстеразные ферменты в Т-центре, разрушающие сложноэфирную связь между последней карбоксильной группой и 3' атомом последней т-РНК. Белок освобождается, рибосома диссоциирует, и все компоненты готовы к новой трансляции (Рис. 4.4).
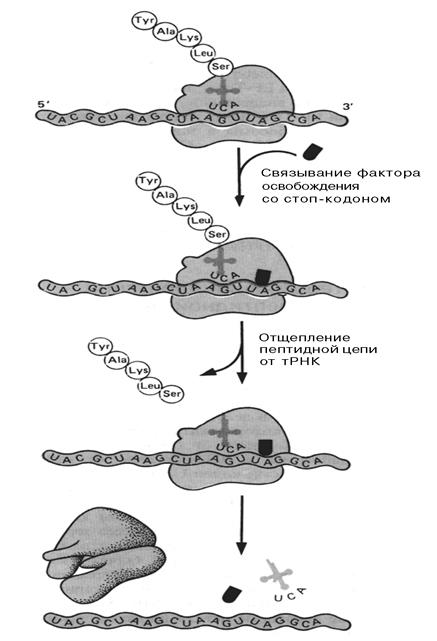
Рис. 4.4 Терминация трансляции
После синтеза белковой молекулы она приобретает вторичную, третичную, четвертичную структуру, и белки готовы к функционированию. Но большая часть аминокислот претерпевает конверсию (происходит в различных местах присоединение ОН-групп, превращение цистеина в цистин, фосфорилирование, и др.).
Часть белков в клетке синтезируется свободными рибосомами – это белки цитозоля. Если же белки предназначены для экспорта (секретирование) вне клетки либо для конкретных внутриклеточных компартментов или для встраивания мембран, то для синтеза таких белков предусмотрен особый механизм. Особенность его закодирована в генах, так что синтезированная м-РНК на своем 5'-конце содержит небольшую последовательность нуклеотидов, кодирующих синтез лидерной последовательности белка (20–30 аминокислот). Рибосома, начавшая синтез такого белка после лидерной последовательности, блокируется специальными молекулами. После этого синтез белка продолжаться не может, и такая рибосома должна связаться своей большой субъединицей на гранулярном ЭПР. Рядом с рибосомой всегда имеются специальные поры, построенные из особых белковых молекул, обеспечивающих транспорт всей белковой цепочки и лидера внутрь каналов ЭПР.
В комплексе Гольджи происходит вторичное гликозилирование – к олигосахариду пристраиваются некоторые углеводные фрагменты цепочек. Здесь же происходит модификация секретов (сульфатирование, фосфорилирование, и др.). Комплекс Гольджи обеспечивает секретирование и адресацию синтезированных молекул с помощью формирования окаймленных (округленных клатрином) пузырьков, снабженных специальными рецепторами для узнавания места своего транспорта.
Глик, Пастернак Молеклярная биотехнология. Принципы и применение 2002 589с
Биохимия. Краткий курс с упражнениями и задачами
Гены и геномы. Льюис
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.