![]() .
.
Если Т и Р постоянны, то изменение свободной энергии Гиббса при протекании реакции равно полезной работе, которая есть максимальная полезная работа, если процесс проводится обратимо:
![]() .
(2)
.
(2)
Сопоставляя выражения (1) и (2), получаем следующее соотношение:
![]() ,
(3)
,
(3)
где Е – разность электродных потенциалов.
Соотношение (3) очень важно, так как даёт простую связь между легко измеряемой величиной E и изменением энергии Гиббса в ходе реакции. Рассмотрим, элемент Даниэльса – Якоби, в котором протекает реакция
![]() .
(I)
.
(I)
Измеряя разность
потенциалов E между цинковой и медной
пластинками этого элемента, мы легко получаем величину ![]() . Столь же легко могут быть найдены и
многие другие термодинамические характеристики реакции. Например, дифференцируя
соотношение (3) по температуре, получаем выражение для изменения энтропии в
ходе реакции:
. Столь же легко могут быть найдены и
многие другие термодинамические характеристики реакции. Например, дифференцируя
соотношение (3) по температуре, получаем выражение для изменения энтропии в
ходе реакции:
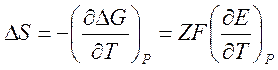 .
.
Следовательно, измерение температурного коэффициента разности электродных потенциалов гальванического элемента фактически эквивалентно измерению изменения энтропии при протекании в нём химической реакции.
Уравнение изотермы химической реакции применительно к процессу (I) выглядит следующим образом:
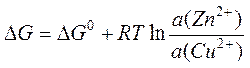 ,
,
где
a(Zn2+) и a(Cu2+) – активности (концентрации)
соответствующих ионов в растворах, а ![]() –
стандартная энергия Гиббса. Если разделить обе части этого уравнения на (–Z×F) и учесть соотношение (3), получим следующее
равенство:
–
стандартная энергия Гиббса. Если разделить обе части этого уравнения на (–Z×F) и учесть соотношение (3), получим следующее
равенство:
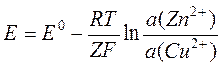 ,
,
где Z – число электронов, переносимое при протекании одного акта реакции (I), а E0 (= 0,916 В) – разность стандартных электродных потенциалов. Это уравнение Нернста, написанное для процесса в элементе Даниэльса – Якоби.
В общем случае уравнение Нернста может быть записано, как
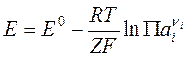 ,
(4)
,
(4)
где ![]() – произведение
реакции, а Е0 – стандартная разность электродных потенциалов гальванического
элемента, т. е. значение, которое принимает величина Е,
если активности ионов и летучести газов, входящие в уравнение Нернста, равны
единице. Величина E0
связана с константой равновесия токообразующей реакции соотношением
– произведение
реакции, а Е0 – стандартная разность электродных потенциалов гальванического
элемента, т. е. значение, которое принимает величина Е,
если активности ионов и летучести газов, входящие в уравнение Нернста, равны
единице. Величина E0
связана с константой равновесия токообразующей реакции соотношением
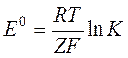 .
.
Иногда при написании уравнения Нернста в произведение реакции включают «активности конденсированных фаз», а затем полагают их равными единице. Такой приём полезен как мнемоническое правило.
Уравнение Нернста можно применить не только к гальваническому элементу в целом, но и к составляющим его электродам. Следует учитывать, что электродные реакции принято записывать в справочниках как реакции восстановления. Поэтому цинковому электроду (электроду Zn2+|Zn) отвечает электродная реакция
Zn2+ + 2e– ® Zn,
а медному электроду (электроду Cu2+|Cu) – электродная реакция
Cu2+ + 2e– ® Cu.
Уравнение Нернста для цинкового и медного электродов может быть записано соответственно как
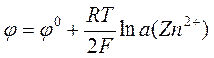 ,
,
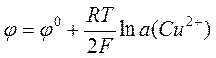 .
.
Для железоионного электрода Pt½Fe3+,Fe2+
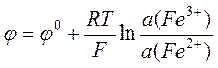 .
.
В общем случае уравнение Нернста для полуэлемента (электрода) может быть записано, как
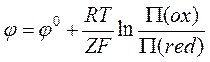 ,
(5)
,
(5)
где
![]() и
и ![]() –
произведения активностей окисленных и восстановленных форм соответственно.
–
произведения активностей окисленных и восстановленных форм соответственно.
Как
известно, для самопроизвольно протекающего процесса при P,
Т = const выполняется условие ![]() .
Поэтому в силу соотношения (3) реакция в гальваническом элементе будет
самопроизвольно протекать слева направо, если Е > 0. Для того чтобы
знак разности электродных потенциалов элемента имел положительное значение,
используют следующие правила:
.
Поэтому в силу соотношения (3) реакция в гальваническом элементе будет
самопроизвольно протекать слева направо, если Е > 0. Для того чтобы
знак разности электродных потенциалов элемента имел положительное значение,
используют следующие правила:
– При символической записи гальванического элемента его изображают таким образом, что на левом электроде идёт процесс окисления, т. е. он является анодом, а на правом электроде идёт восстановление, т. е. он является катодом. Например, в элементе Даниэльса – Якоби процесс на левом электроде Zn®Zn2+ + 2e–, а на правом электроде Cu2+ + 2e–®Cu. Данный элемент изображается как Zn|Zn2+||Cu2+|Cu. При этом одинарная вертикальная черта означает границу раздела фаз, двойная черта – солевой мостик; вещества, находящиеся в одной фазе, пишутся через запятую.
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.