Таблица 1
Значения констант A и Bдля водных растворов
|
T, 0C |
A, [моль-1/2 л1/2] |
B, [нм-1 моль-1/2 л1/2] |
|
25 |
0,509 |
3,29 |
|
30 |
0,514 |
3,30 |
|
35 |
0,519 |
3,31 |
|
40 |
0,524 |
3,32 |
|
50 |
0,535 |
3,34 |
|
60 |
0,547 |
3,37 |
Второе приближение справедливо до концентраций около 10-1 М. При больших концентрациях используют третье приближение
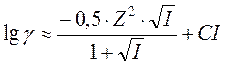 .
.
Величина С – это эмпирическая константа.
Приведенные выше формулы дают возможность расчёта коэффициента активности отдельного иона, помещённого в раствор электролита с ионной силой I. При этом активность ионов данного сорта есть произведение коэффициента активности на их концентрацию. Поскольку при диссоциации электролита всегда образуются как катионы, так и анионы, то в большинстве случаев для характеристики свойств раствора достаточно знать комбинацию коэффициентов активности положительных и отрицательных ионов, называемую среднеионный коэффициент активности g±. Для электролитов типа KCl или HCl, диссоциирующих на однозарядные катион и анион (1,1-валентные электролиты или 1,1-электролиты), среднеионный коэффициент активности g± по определению равен
![]() .
.
Для электролитов с другими типами валентности связь g± с коэффициентами g+ и g– см., например, в [11, 12].
Зависимость среднеионного коэффициента активности от ионной силы раствора в первом, втором и третьем приближении теории Дебая – Хюккеля задается соотношениями, похожими на соответствующие формулы для отдельного иона.
![]() ,
,
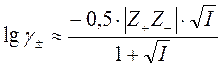 ,
,
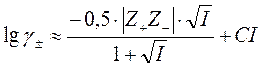 .
.
Вывод этих выражений можно посмотреть, например, в [11].
Ещё одной важной характеристикой растворов является активность электролита. Хотя этот термин является общепринятым, его нельзя признать удачным, так как он вызывает неверные ассоциации. В химической термодинамике активность вводится в теории реальных растворов как величина, аналогичная концентрации вещества в идеальном растворе и имеющая размерность концентрации. В электрохимии и теории электролитической диссоциации термином «активность электролита» обозначается нечто иное. Так, для сильного 1,1-электролита его активность a по определению равна
![]() ,
,
где m – моляльность раствора. Видно, что активность электролита соотносится с концентрацией электролита таким же образом, как произведение растворимости электролита соотносится с его растворимостью. Размерность величины a иная, чем размерность концентрации и зависит от типа валентности электролита. Для электролитов с различными типами валентности формулы, связывающие a с величинами m и g± , приведены, например, в справочнике [12] и в учебниках.
Задача П-1
ПОТЕНЦИОМЕТРИЧЕСКОЕ ОПРЕДЕЛЕНИЕ КОЭФФИЦИЕНТОВ АКТИВНОСТИ СОЛЯНОЙ КИСЛОТЫ
Целью лабораторной работы является измерение стандартной ЭДС хлорсеребряного электрода и определение зависимости среднеионного коэффициента активности ионов H+ и Cl– от концентрации соляной кислоты.
Для определения коэффициентов активности соляной кислоты потенциометрическим методом удобно использовать гальванический элемент, составленный из водородного и хлорсеребряного электродов с HCl в качестве электролита.
![]()
В элементе протекает реакция
1/2 H2(газ) + AgCl(тв) = HCl(m) + Ag(тв).
Потенциал левого (водородного) электрода равен
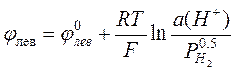 .
.
Если давление водорода равно 1 атм, то
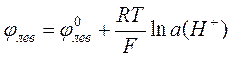 .
.
Потенциал правого (хлорсеребряного) электрода
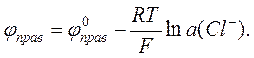
Разность электродных потенциалов элемента, составленного из этих электродов
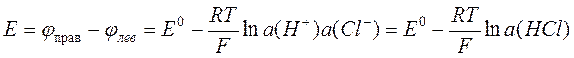 ,
,
где E0 – стандартная разность электродных потенциалов элемента. Поскольку концентрации H+ и Cl– равны, формула сводится к следующей:
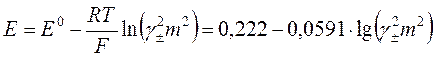 .
.
Если измерена величина E в зависимости от m и известна j0 для хлорсеребряного электрода, то расчёт среднеионного коэффициента активности как функции m тривиален. Пример расчёта, приводящего к общепринятым значениям g±, показан в табл. 2.
Таблица 2
Расчет среднеионного коэффициента активности
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.