|
m, моль/кг |
|
Е, В |
lg m |
|
|
справочн. |
Сравнить
найденные значения ![]() со справочными данными.
Построить график зависимости
со справочными данными.
Построить график зависимости ![]() от
от ![]() . Для проведения расчетов рекомендуется использовать программу Excel,
для построения графиков – Origin.
. Для проведения расчетов рекомендуется использовать программу Excel,
для построения графиков – Origin.
Задача П-2
ОПРЕДЕЛЕНИЕ КОНСТАНТЫ ДИССОЦИАЦИИ СЛАБОЙ КИСЛОТЫ ПОТЕНЦИОМЕТРИЧЕСКИМ МЕТОДОМ
При выполнении лабораторной работы предлагается решить две задачи:
– познакомиться с методом потенциометрического титрования и определить концентрацию неизвестного раствора кислоты;
– потенциометрическим методом определить константу диссоциации слабой кислоты.
Обе они могут быть решены с использованием одного и того же массива экспериментальных данных, а именно, кривой титрования, т. е. зависимости рН раствора слабой кислоты от количества добавленной щелочи.
Потенциометрическое титрование является стандартной несложной процедурой. При любом виде титрования измеряется некоторое свойство раствора, которое характерным образом изменяется вблизи точки эквивалентности (например, окраска раствора, в который добавлен индикатор). При кислотно-основном потенциометрическом титровании измеряемой величиной является рН раствора. Кривая титрования имеет S-образный вид, в точке эквивалентности на зависимости рН от количества прилитого титранта наблюдается точка перегиба. Поскольку точке перегиба отвечает максимум первой производной, для более точного определения положения точки эквивалентности можно построить дифференциальную кривую.
Способ решения второй задачи тоже ясен. В разбавленном растворе слабой кислоты знание рН эквивалентно (почти) знанию концентрации протонов в растворе. Поскольку общая концентрация кислоты известна, то, поделив концентрацию H+ на концентрацию кислоты, получаем степень диссоциации, а её легко пересчитать в константу равновесия. В принципе, для всего этого достаточно измерить рН раствора кислоты, но коль скоро в нашем распоряжении будут иметься данные, полученные при титровании, то можно использовать и их. При более строгом рассмотрении необходимо учесть, что рН определяется всё же не концентрацией, а активностью протонов, а Ka и Kс– разные константы.
Целью данной работы является определение концентрации слабой одноосновной кислоты (уксусной, или муравьиной – по указанию преподавателя) методом потенциометрического титрования и определение её константы диссоциации. Константа диссоциации кислоты выражается следующим образом:
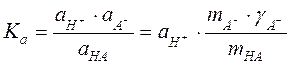 .
.
Здесь учтено, что
для недиссоциированной кислоты ![]() . Логарифмируя,
получаем
. Логарифмируя,
получаем
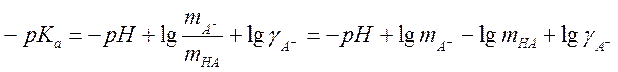 .
.
Дальнейшие расчёты зависят от того, имеем ли мы дело с раствором чистой HCl или с серией растворов, которые образуются в процессе титрования исходного раствора щелочью.
В первом случае концентрации ионов A– и H+, образующихся при диссоциации кислоты, равны между собой:
![]() .
.
Если в качестве простого приближения принять, что коэффициенты активности всех частиц близки к единице, то получается
![]()
т. е.
![]() .
.
Для разбавленных растворов слабо диссоциирующих кислот, типа уксусной кислоты, это достаточно хорошее приближение. Подробнее о диссоциации слабой кислоты см. учебник [13].
Во втором случае, когда анализируются данные, полученные для серии растворов в ходе потенциометрического титрования, следует учитывать коэффициенты активности. Рассмотрим процесс нейтрализации слабой одноосновной кислоты НА сильным одноосновным основанием, например KOH:
HA + KOH = KA + H2O.
Обозначим исходную концентрацию кислоты символом a, концентрацию добавленной щелочи в титруемом растворе – символом b. Величина b увеличивается по мере добавления щелочи.
Если соль KA является сильным
электролитом, то концентрация катионов K+ (![]() ) в рабочем растворе равна концентрации
добавленной щелочи b. Поскольку общее количество анионов равно количеству
катионов, то
) в рабочем растворе равна концентрации
добавленной щелочи b. Поскольку общее количество анионов равно количеству
катионов, то
[K+] + [H+] = [A–] + [OH–],
откуда следует
[A–] = b +[OH–] –[H+].
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.