Концентрация недиссоциированного гидрата окиси аммония может быть определена из соотношения (2-9)
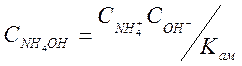 (3-18)
(3-18)
Подставив значение ![]() из уравнения (3-17) и
из уравнения (3-17) и ![]() , получим :
, получим :
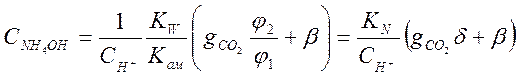 (3-19)
(3-19)
Поскольку в растворе
присутствуют ![]() и
и ![]() ,
целесообразно в уравнение (3-17) ввести общее количество аммиака, т.е.
,
целесообразно в уравнение (3-17) ввести общее количество аммиака, т.е.![]()
Подставив значения слагаемых из соотношений (3-17) и (3-19), в результате преобразований получим :
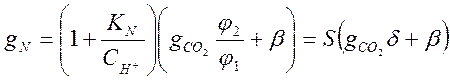 (3-20)
(3-20)
Примеры
3-1. Определить рН растворов бикарбоната аммония.
Решение.
Если в чистом
конденсате находится в растворе только NH4HCO3, то ![]() . Тогда уравнение
(3-20) может быть записано так :
. Тогда уравнение
(3-20) может быть записано так :
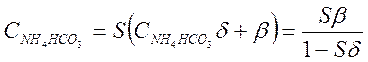
Если β=0, что имеет
место при рН≤7 (таблица 2.1), то ![]() . Это- нижний предел
рН.
. Это- нижний предел
рН.
Верхний предел рН
определяется условием ![]() , т.е. при
, т.е. при ![]()
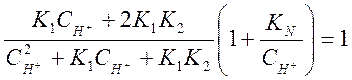
Слагаемыми
![]() и
и ![]() можно
пренебречь, тогда решение этого равенства приводит к выражению
можно
пренебречь, тогда решение этого равенства приводит к выражению ![]() что даёт при 298 К рН ≈ 7,8.
что даёт при 298 К рН ≈ 7,8.
Значение рН=7,8 достигается при концентрации бикарбоната аммония примерно 2,8 мг/кг. Эти данные показывают, что рН >8 нельзя создать нейтрализацией углекислоты аммиаком до NH4HCO3.
4.Система Н3РО4 – NaОН – Н2О
В результате присосов в конденсаторе питательная вода загрязняется примесями , в том числе соединениями кальция и магния, которые затем поступают в котёл. В процессе парообразования при высоком давлении в котловой воде сравнительно легко достигаются концентрации, приводящие к образованию накипи. Для связывания кальция обычно применяют соли фосфорной кислоты ( обычно в котловую воду вводят смесь Na3PO4 и кислых солей NaH2PO4 и Na2HPO4).
Фосфат –тринатрийфосфат Na3PO4·H2O (или Na3PO4·12H2O) вводится непосредственно в барабан котла для связывания Са2+ в гидроксилапатит Са10(РО4)6(ОН)2 ( в меньшей степени для связывания Mg2+ в nMgO·mP2O5). Железо связывается с РО43- в FePO4 или в NaFePO4 лишь при высокой концентрации РО43- (100 мг/л и более) и низкой щёлочности (рН менее 9,0).
Кислые фосфаты: динатрийфосфат Na2HPO4·12Н2О, гексаметафосфат (соль Грахама) (NaPO3)n и триполифосфат Na5P3O10 – можно применять лишь при наличии щелочной воды (NaOH, Na2CO3, NaHCO3). В настоящее время стараются избегать применения кислых фосфатов, так как наличие в котловой воде свободного NaOH оказывается полезным для замедления или предотвращения пароводяной коррозии металла [3].
Соли фосфорной кислоты вводятся в котловую воду, где происходит их гидролиз со следующими реакциями:
![]() (4-1)
(4-1)
![]() (4-2)
(4-2)
![]() (4-3)
(4-3)
При растворении в конденсате фосфорной кислоты протекают следующие реакции:
![]()
![]()
![]() ,
,
характеризующиеся
соответственными константами равновесия при ![]() =298 К:
=298 К:
![]() ;
; ![]() ;
; ![]() .
.
Отсюда концентрации анионов будут равны:
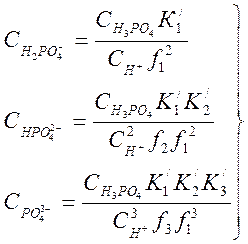 (4-4)
(4-4)
Общая концентрация фосфатов составляет:
![]()
![]() (4-5)
(4-5)
Заменив концентрации ионов выражениями (4-4), и при условии ![]() получим:
получим:
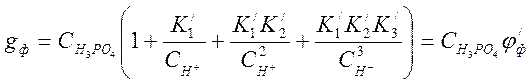 (4-6)
(4-6)
Для раствора, содержащего Н3РО4 и NaОН
, условие электронейтральности напишется так :![]()
или
при использовании (4-4), замены ![]() получим:
получим: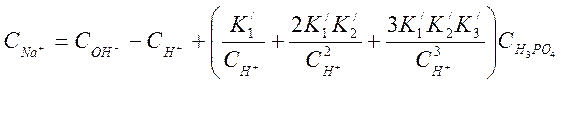
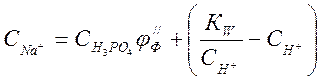
Но
по уравнению (4-6) ![]() , тогда
, тогда
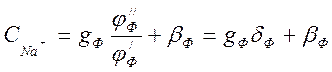 (4-7)
(4-7)
Если в конденсате
растворено ![]() , моль/кг, какой-либо натриевой соли
фосфорной кислоты, то концентрация натрия равна:
, моль/кг, какой-либо натриевой соли
фосфорной кислоты, то концентрация натрия равна:
![]()
Подставив это
значение ![]() в уравнение (4-7), получим:
в уравнение (4-7), получим:
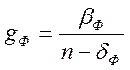 ,
(4-8)
,
(4-8)
где
![]() для NaH2PO4 ;
для NaH2PO4 ; ![]() для Na2HPO4 и
для Na2HPO4 и ![]() для Na3PO4.
для Na3PO4.
Примеры
4-1. Определить рН раствора моно-, ди- и тринатрийфосфата.
Решение.
Для растворов
мононатрийфосфата равенство (4-8) имеет вид : 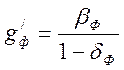 .
.
Оно имеет физический смысл
только при положительных значениях ![]() , что достигается при
, что достигается при ![]() >1, при которых
>1, при которых ![]() <0
(смотри таблицу 4.1). Минимальное рН, при котором
<0
(смотри таблицу 4.1). Минимальное рН, при котором ![]() >1,
примерно равно 4,7, что легко установить интерполяцией, пользуясь данными
таблицы 4.1 .
>1,
примерно равно 4,7, что легко установить интерполяцией, пользуясь данными
таблицы 4.1 .
Таблица 4.1 Численные
значения величин ![]() ,
,![]() ,
,![]() ,
,![]() для системы H3PO4 – NaOH – H2O
для системы H3PO4 – NaOH – H2O
Уважаемый посетитель!
Чтобы распечатать файл, скачайте его (в формате Word).
Ссылка на скачивание - внизу страницы.